Elementi, imenovani po zemeljskoalkalijske kovine so tisti, ki pripadajo družini 2 ali IIA, periodnega sistema. Takšno skupino sestavljajo naslednji kemični elementi: Be (berilij), Mg (magnezij), Ca (kalcij), Sr (stroncij), Ba (barij) in radij (Ra).

V valentni lupini imajo dva elektrona, njuno generično porazdelitev pa predstavlja ns2, kjer št predstavlja številko zadnje ravni. Zaradi te lastnosti ponavadi izgubljata ta dva elektrona, kar povzroči 2+ kationa naboja.
Izraz "zemlja" se nanaša na "obstoječe na zemlji", saj so tu ti elementi, predvsem v mineralih. Na primer kalcij v obliki spojine kalcijevega fosfata (Ca3(PRAH4)2), se nahaja v zemeljski skorji in služi kot surovina za proizvodnjo fosforja. Prisoten je tudi v kosteh živali, tako da, ko se te žgejo, dobimo tako imenovano "kostno moko", ki vsebuje kalcijev fosfat.
Med zemeljskoalkalijskimi kovinami najbolj izstopajo Kalcij to je Magnezij.
- Kalcij
Kalcijev ion (Ca2+) je prisoten v približno 90% naših kosti in zob; in pri živalih je prisoten tudi v njihovih lupinah. Njegova naloga je okrepiti kostno strukturo in služiti kot mišični relaksant. Pomanjkanje kalcija v telesu lahko povzroči mišične krče, tetanus in osteoporozo. Zato je pomembno, da ga uživate s hrano, bogato s kalcijem, kot so mleko in njegovi derivati (maslo, sir itd.), Meso in zelenjava.
Po drugi strani pa lahko preveč kalcija povzroči sprostitev mišic, ledvične kamne in bolečine v kosteh.
Poleg omenjenih živil je kalcij še vedno prisoten v mnogih delih narave, zlasti v mineralih, kot je kalcit (CaCO3) ali kalcijev karbonat, ki je sestavni del apnenca in marmorja, marmor pa se uporablja pri izdelavi ponorov, kipov, tal in stopnišč. Kalcijev karbonat je tudi nosilec kapnikov in kapnikov v jamah. Kalcij je prisoten tudi v naravni sadri (CaSO4. 2 uri2O), ki se imenuje mavec. Ta sol je lahko dehidrirana in povzroči nastanek CaSO4 brezvodna, kar je šolska kreda.
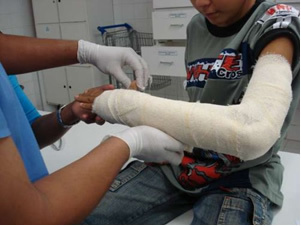
V industriji se proizvaja deviško apno (CaO), gašeno apno, imenovano tudi hidratirano apno ali gašeno apno, ki je pravzaprav kalcijev hidroksid (Ca (OH)2), ki se uporablja pri beljenju barv in pri pripravi malte. Nežno segrevanje sadre omogoča pridobitev hemihidriranega kalcijevega sulfata, ki je sadra, ki se uporablja v gradbeništvu civilne družbe pri izdelavi kalupov v zobozdravstvu in medicini za zaščito zlomov kosti, kot je spodaj prikazana roka.
- Magnezij
ion magnezija ima tudi velik biološki pomen, saj je prisoten v 70% naših kosti, kar daje prednost delovanju encimov, mišic in motorične koordinacije. Pomanjkanje v telesu lahko povzroči dezorientacijo, hipertenzijo, tresenje in šibek utrip. Zato bi morali jesti naslednja živila, ki vsebujejo ta element: oreščki, žita in zelena zelenjava. Tudi presežek magnezija v telesu lahko povzroči zaspanost.
Magnezij obstaja tudi v morski vodi in mineralih. Uporablja se v kovinskih zlitinah, kot so žrtvene kovine (ki oksidirajo namesto jekla in preprečujejo njegovo korozijo), v magnezijevih kolesih in v ognjemetih (v srebrni in beli barvi). Zelo pomembna magnezijeva spojina je magnezijev hidroksid (Mg (OH)2), ki pri razpršitvi v vodi pri koncentraciji približno 7% povzroči nastanek znane suspenzije popularno kot magnezijevo mleko, ki služi kot antacid, ki se bori proti kislosti v želodcu (zgaga) in kot odvajalo.

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm


