Kloridi so tiste ionske spojine, ki vsebujejo anion Cℓ-1.
Klor je iz družine 17 ali 7A, njegovo atomsko število je enako 17 in ima 7 elektronov v valentni lupini (najbolj zunanji elektronski lupini atoma). Po navedbah pravilo okteta, da bo stabilna, mora imeti v tej zadnji lupini 8 elektronov in zato mora prejeti še en elektron več. Ko se to zgodi, torej ko prejme elektron, na splošno iz ionske vezi s kovino nastane â.nionov klorid (Cℓ-1), kovina, ki se je predala elektronu, postane kation in nastala snov je ionska.
Kloridi so soli, pridobljene iz reakcije baze s klorovodikovo kislino (HCℓ(tukaj)). Osnova zagotavlja kation, klorovodikova kislina pa daje kloridni ion:
Generična baza + klorovodikova kislina → Klorid + voda
ÇOH + HCℓ → ÇCℓ + H2O
Vsi kloridi so razvrščeni kot anorganske soli, ker v vodnem mediju sproščajo kation, ki ni H+ in sprostite kloridni anion, ne hidroksil (OH-).
Nomenklatura kloridov vedno sledi temu pravilu: Klorid +de + (ime elementa, povezanega s klorom). Ob vaše formule so oblikovane
izmenjava ionskih nabojev za indekse (številka v spodnjem desnem kotu simbola elementa, ki označuje število prisotnih atomov tega elementa, ki tvorijo vezi).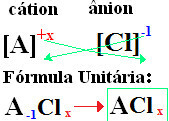
če indeks je "1", vam ga ni treba zapisati v formulo, kot je prikazano spodaj:
Ob+1 Cℓ-1 → Ob1Cℓ1 → ObCℓ: natrijev klorid;
K+1 Cℓ-1 → KCℓ: kalijev klorid;
Tukaj+2 Cℓ-1→CaCℓ2: kalcijev klorid;
Ba+2 Cℓ-1→ Btukaj2: barijev klorid;
Aℓ+3 Cℓ-1→ACℓ3: aluminijev klorid.
Vendar, kot je razloženo v besedilu „Jonske snovi iz skupine: klorid, karbonat, nitrat in sulfat", Tako kot pri vseh ionskih snoveh tudi pri kloridih v svoji naravi niso izolirane enotne formule, saj se njihovi ioni medsebojno privlačijo in tvorijo kristalne rešetke.
Glavni primer klorida, ki ga imamo v vsakdanjem življenju, je natrijev klorid, NaCℓ, kuhinjska sol. Oglejte si ionsko vez, ki povzroči njeno tvorbo (v kateri natrij donira elektron kloru) in pod kristalno rešetko te soli:
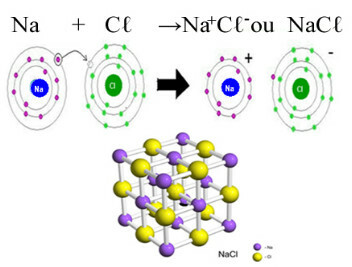
V kristalni rešetki natrijevega klorida vsak anion Cℓ- je obdan s 6 kationi Na+ in obratno, torej je koordinacijsko število te kristalne mreže 6.
Vsi kloridi so trdne snovi v okoliških pogojih in čisto vodotopen, ki je med najpogostejšimi solmi, ki jih najdemo v našem vsakdanjem življenju, glede na to, da jih je več so prisotni raztopljeni v mineralni vodi, pitni vodi, vodovodni vodi, rekah in morjih drugi. Med izjemami, ki so v vodi netopni kloridi, so srebrov klorid (AgCℓ - prikazan na naslednji sliki), iz spojine svinca, bakra in živega srebra.

V vodi netopen srebrni klorid *
Ioni Cℓ-1 iz kloridov, ki jih zaužijemo, predvsem v sol, ribe in meso, so pomembni za nekatere funkcije človeškega telesa, saj so glavni zunajcelični anion, ki je prisoten v soku želodca, uravnavajo telesne tekočine, kot je porazdelitev vode v telesu, in vzdržujejo osmotski tlak in nevtralnost plazme električni.
Njegovo pomanjkanje lahko povzroči tesnobo, drisko in težave s krvnim obtokom. Njegov presežek se izloči z urinom (v povprečju vsak človek izloči približno 4 g klorida na dan), znojem in blatom.
*Kreditna slika: Avtor: Danny S. / Slika izvlečena iz: Wikimedia Commons
Avtorica Jennifer Fogaça
Diplomiral iz kemije
