Organske spojine so molekularne, to pomeni, da njihovi atomi med seboj nosijo kovalentne vezi. Ko analiziramo vezi med ogljiki, ki so lahko enojne, dvojne ali trojne, opazimo, da so nepolarne vezi, saj med atomi ni razlike v elektronegativnosti, saj pripadajo istim element.
Ker imata vodik in ogljik zelo majhno razliko v elektronegativnosti, so tudi vezi med njimi nepolarne.
Nepolarne povezave:
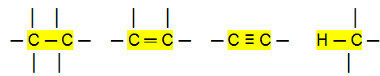
S tem lahko sklepamo, da Ogljikovodiki (organske spojine, ki imajo samo atome ogljika in vodika) so nepolarne molekule. V teh spojinah je medmolekularna interakcija induciranega dipolnega tipa, ki je najšibkejša od obstoječih.
Ker so šibke, je te interakcije enostavno prekiniti. Zaradi tega, temperature vrelišča in tališča ogljikovodikov so nižje kot pri drugih funkcijah.

Primerjava ogljikovodikov, vrelišča se bodo povečala, ko se bo povečala tudi molska masa.
Na primer, etan in butan sta alkana. Oglejte si vrelišča vsakega eksperimentalno določenega:
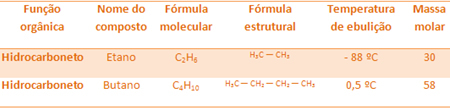
Upoštevajte, da je temperatura vrelišča butana veliko višja od temperature etana, saj je tudi njegova molska masa višja.
Zdaj, ko primerjamo ogljikovodike z enako molsko maso (so izomeri), ki pa imajo različne vrste ogljikovih verig, ugotovimo, da večje je število vej, nižja je temperatura vrelišča, ker struktura molekule postane bolj kompaktna, to pomeni, da se njena površina zmanjša.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Vsi alkani spodaj imajo enako molekulsko formulo C5H12, vendar so njihove temperature vrelišča različne:
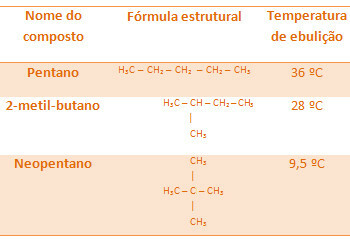
Upoštevajte, da je temperatura vrelišča neopentana najnižja, saj ima več vej.
Lahko mislimo, da druge organske funkcije izvirajo iz ogljikovodikov z nadomestitvijo enega ali več vodikov z atomi ali skupinami atomov drugih elementov. Na splošno imajo druge organske funkcije kisik ali dušik, ki sta bolj elektronegativni elementi kot ogljik. Močneje privlačijo elektronski par, ki ga delimo z ogljikom, in tako molekulo naredimo polarno:
Polarne povezave:
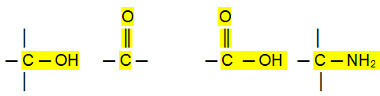
Aldehidi, ketoni in organski halogenidi imajo višje vrelišča kot ogljikovodikov, ker je njihova medmolekularna interakcija stalni dipol, ki je močnejši od tistega v inducirani dipol.
Alkoholi, karboksilne kisline in amini pa imajo še višje temperature vrelišča, saj izvajajo vodikove vezi, najbolj intenzivno vrsto medmolekularne interakcije.
Za spojine vseh teh funkcij velja enako, kot smo videli za ogljikovodike:

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Polarnost in temperatura vrelišča organskih spojin"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm. Dostopno 28. junija 2021.

