THE elektronegativnost je težnja atoma, da pritegne elektrone k sebi, ko je povezan z drugim kemičnim elementom. skozi kovalentno vez, to je v kateri se delijo elektroni, pri čemer se upošteva ta molekula izoliran.
Oglejmo si dva primera za boljše razumevanje predstavljenega koncepta:
1. primer: molekula vodikovega plina: H2 → H - H
Ko se dva atoma vodika združita, se hkrati pojavijo privlačne sile med jedri vsakega. enega od teh atomov z elektronom drugega atoma in odbojne sile med elektroni in jedroma obeh atomi. Ko te sile dosežejo ravnovesje, sta elektrona v območju elektrosfer, ki je nekje med obema. atomi molekule, v katerih oba sodelujeta z obema elektronoma, postaneta stabilna, to pomeni, da imata dva atoma par elektroni.

To je kovalentna vez, ki tvori molekulo. A ker sta si dva atoma te molekule popolnoma enaka, je tudi način privabljanja elektronov drug k drugemu enak. Tako rečemo razlike v elektronegativnosti ni ali da ona to je apolar.
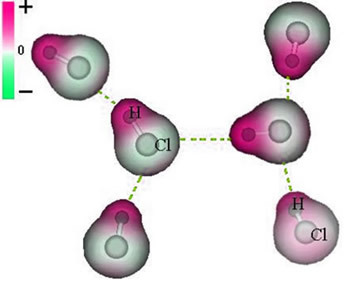
2. primer: Molekula vodikovega klorida: HCℓ
V tem primeru se izmenjava elektronskega para izvaja med različnimi elementi, ker v zvezi s tem atom klora privlači elektrone z večjo jakostjo kot vodik. Zato pravimo, da je klor bolj elektronegativen kot vodik.
Kot je prikazano na spodnji sliki, je zaradi razlike v elektronegativnosti a električni dipol (μ), to sta dva električna monopola, pri čemer elektrone bolj privlači klor. Tako bo imela vez H ─ Cℓ delni negativni naboj na kloru (δ-) in delni pozitivni naboj na vodiku (δ+). To je torej molekula z razliko elektronegativnosti in je polarni:

To nam kaže, da je elektronegativnost relativna količina in ne absolutna, saj jo določimo ob upoštevanju primerjav sil, ki jih imajo atomi v kovalentni vezi.
Obstaja več načinov za izračun elektronegativnosti, najpogostejši pa je lestvica elektronegativnosti, ki jo je predlagal Pauling. Recimo, da imamo generično molekulo A ─ B. Pauling je predlagal, da bi bila vezavna energija te molekule, ki jo simbolizira D, podana v vsoti aritmetične sredine vezavnih energij (D) molekul plina teh dveh atomov, to je A-A in B-B, s kvadratom razlike v elektronegativnosti vsakega atoma te molekule (xTHE in xB):
Ne ustavi se zdaj... Po oglaševanju je še več;)
D(A-B) = [D(A-A) + D(B-B)] + k (xTHE - xB)2
Konstanta k v zgornji formuli je enaka 96,5 kJ. mol-1. Pauling je dodelil poljubno vrednost elektronegativnosti vodika, ki je bila 2,1, in, na ta način je bilo mogoče odkriti vrednost elektronegativnosti drugih elementov glede na on.
Na podlagi te metode so bile podane vrednosti Paulingove elektronegativnosti za elemente periodnega sistema, z izjemo plemenitih plinov.

Upoštevajte, da so te vrednosti periodična lastnost, saj se občasno spreminjajo glede na atomska števila elementov. Glejte na primer, da so najbolj elektronegativni elementi tisti v zgornjem desnem kotu mize, to je fluor (4.0) in kisik (3.5), najmanj elektronegativni pa so tisti v spodnjem levem kotu, to sta francij (0.8) in cezij (0,8).
Na podlagi tega je bila celo ustvarjena vrsta elektronegativnosti najbolj elektronegativnih elementov, ki se ponavadi najbolj obdelujejo:
F> O> N> Cℓ> Br> I> S> C> P> H
Oglejte si vrednosti elektronegativnosti:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Za okrasitev te vrste elektronegativnosti obstaja nekakšen "trik", ki ga daje spodnji stavek, v katerem začetnica vsake besede ustreza simbolu zadevnih elementov:
“Fživjo Onimam NO Klube, brimam jazsJoj Çumiranje Pza Hbolnišnica"
Tako lahko rečemo elektronegativnost je periodična lastnost, ki se v periodnem sistemu poveča od leve proti desni in od spodaj navzgor.

To je zaradi velikosti atomskega polmera. Večji kot je polmer atoma, bolj oddaljeni so skupni elektroni od njegovega jedra in zato je šibkejša privlačnost med njimi. Velja tudi nasprotno, manjši je atomski polmer, bližje kot bodo elektroni jedru in večja privlačnost med njimi. Tako lahko sklepamo naslednje:
Elektronegativnost narašča z zmanjšanjem atomskega polmera.
Avtorica Jennifer Fogaça
Diplomiral iz kemije