entropija je a veličinotermodinamika povezan z nepovratnost stanja fizičnega sistema. Običajno je povezano s stopnjo "motnja"Ali"naključnost”Sistema. Po eni od izjav 2. zakon termodinamike:
“V toplotno izoliranem sistemu se mora merjenje entropije sčasoma vedno povečati, dokler ne doseže svoje največje vrednosti. "
Z drugimi besedami, entropija lahko izmeri pomen "puščica časa”Sistema. Ko vidimo spodnje slike, intuitivno vemo, da začetno stanje sistema predstavlja slika sistema levo, največjih organizacija:
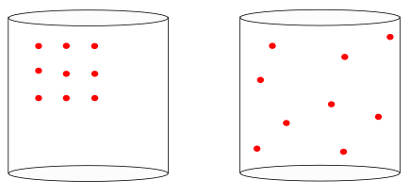
Če pogledamo prejšnjo sliko, vemo, da je najverjetnejša končna konfiguracija tista, v kateri imajo atomi hitrosti v vse smeri, tako dobro, kot naključni položaji. V tem je entropija: a večkratnost stanja sistema vedno povečati.
Primeri
Katera od spodnjih nastavitev je bolj verjetno ki jih je treba opazovati za razporeditev opeke skozi čas?

V prvi konfiguraciji je večkratnost stanja blokov je malo: vsi so urejeni v smervodoravno, vzporedno drug drugega. S časom ali delovanjem sredstva se pričakuje, da bo njegova konfiguracija
odrasti v številko v Državah, favorizira Ponedeljekkonformacija, prikazano na sliki na desni. Navedemo lahko tudi druge primere:-
Ko se paket ledu postavi v posodo z večjitemperatura, njegova temperatura narašča, dokler ne doseže toplotna bilanca. Takrat se led lahko stopi. S ponovnim jemanjem toplote iz ledenega bloka, ki je zdaj v državi tekočina, lahko spet postane trden, vendar njegova konformacija ne bo imel iste organizacije ki je bila prej predstavljena.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Ko odprete stekleničko parfuma, vam lahko pomaga toplota difuzija svojega molekule, širjenje vsebine parfuma po celotni dolžini sobe. Nasprotno ni mogoče pričakovati, saj odvajanje toplote ne bi spodbudilo vračanja molekul v bučko.
Matematična opredelitev entropije
THE matematična opredelitev entropije poda razmerje med količino toplote (V), prenesena med dvema odsekoma toplotno izoliranega sistema, v džuli (J) po absolutni temperaturi v Kelvin (K):

S = Entropija (J / K)
ΔQ = Količina toplote (J)
T = Absolutna temperatura (K)
Zgornja opredelitev velja za izotermični procesi, to pomeni, da so izmenjave toplote tako majhne (ali počasne), da ne morejo spremeniti temperature sistema. Definicija entropije je torej neskončno majhen (neskončno majhen del).
Pojem entropije lahko razumemo tudi takole: sistem, ki ga tvorita dva dela istega plina, v veliko različnihtemperature, je mogoče izvleči določeno količino delo nekaj ga je premaknil bat ali ročna ročica, na primer. Vendar čez čas, deli tega plina bodo ponavadi ravnovesjetoplotno. Če razlike v temperaturi ne bo več, niti z vso tam prisotno energijo, ne bo mogoče izločiti nobene delokoristno od njega.
Avtor Rafael Hellerbrock
Diplomiral iz fizike
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
HELERBROCK, Rafael. "Kaj je entropija?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. Dostopno 28. junija 2021.