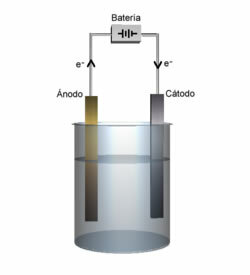
Vsaka celica je naprava, v kateri pride do spontane reakcije redukcije oksidacije, ki ustvarja električni tok, ki pa se uporablja za delovanje nekaterih naprav.
Te naprave so ime dobile zato, ker je prvo baterijo, ki je nastala, izumil Alessandro Že leta 1800 so ga tvorili cinkovi in bakreni diski, ločeni z namočenim bombažem slanica. Ta komplet je bil postavljen v razsek, eden na drugega, kopičenje diskov in tvori velik stolpec. Kako je bilo baterijo diskov, začeli imenovati s tem imenom.

Baterije so vedno sestavljene iz dveh elektrod in elektrolita. Pozitivna elektroda se imenuje a katoda in tu je reakcija zmanjšanje. Negativna elektroda je anoda in tu je reakcija oksidacija. Prav tako se imenuje elektrolit solni most in je ionsko prevodna raztopina.
Če želite razumeti, kako to ustvarja električni tok, glejte primer ene prvih baterij, Danielov kup, v katerem je bila posoda z raztopino bakrovega sulfata (CuSO4 (aq)) in, potopljena v to raztopino, je bila bakrena plošča. V drugem ločenem vsebniku je bila raztopina cinkovega sulfata (ZnSO
4 (aq)) in potopljeno cinkovo ploščo. Raztopini sta bili povezani s solnim mostom, ki je bil steklena cev z raztopino kalijevega sulfata (K2SAMO4 (aq)) s stekleno volno na koncih. Na koncu sta bili plošči med seboj povezani z zunanjim vezjem z žarnico, katere osvetlitev bi kazala na prehod električnega toka: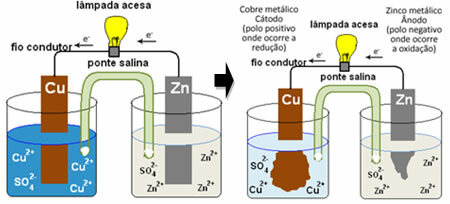
Zgodi se, da ima cink večjo težnjo k oksidaciji, torej k izgubi elektronov, zato kovinski cink rezila deluje kot negativna elektroda, anoda, kjer pride do oksidacije: Zn(s) ↔ Zn2+(tukaj) + 2 in-. Elektroni, ki jih izgubi cink, se po zunanjem vezju prenesejo v baker in ustvarijo električni tok, ki vžge žarnico. Bakrovi ioni v raztopini sprejemajo elektrone (reducirajo se) in se pretvorijo v kovinski baker, ki se odlaga na bakreni plošči. To pomeni, da je to pozitivna elektroda, katoda, kjer pride do zmanjšanja: Ass2+(tukaj) + 2 in- ↔ rit(s).
Ne ustavi se zdaj... Po oglaševanju je še več;)
Današnje baterije imajo to isto načelo delovanja, pri katerem ena kovina skozi prevodno raztopino elektroni donira elektrone in nastane električni tok. Razlika je v tem, da so danes uporabljene baterije suhe, ker kot elektrolit ne uporabljajo tekoče raztopine, kot se dogaja v Danielovi bateriji.
Danes obstaja veliko različnih baterij, ki se prodajajo v komercialne namene. Med njimi so najpogostejši kisle celice (iz Leclanchéja) inalkalne baterije.
Pri obeh je negativna elektroda cink; na drugi strani pa je kot pozitiven pol na sredini kupa nameščena grafitna palica, obdana z manganovim dioksidom (MnO2), oglje v prahu (C) in mokra pasta. Razlika je v tem, da se v kislem kupu v mokri kaši uporablja amonijev klorid (NH).4Cl) in cinkov klorid (ZnCl2) - soli kislega značaja - poleg vode (H2O). V alkalni bateriji se uporablja kalijev hidroksid (KOH), ki je osnova.

Leclanchéjeve baterije so najbolj primerne za opremo, ki zahteva svetlobo in neprekinjeno praznjenje, kot so daljinski upravljalnik, stenska ura, prenosni radio in igrače. Alkalne baterije imajo po drugi strani od 50 do 100% več energije kot običajne baterije enake velikosti, kar je priporočljivo za opremo, ki zahtevajo hitrejše in intenzivnejše prenose, kot so radijski sprejemniki, CD / DVD predvajalniki, prenosni MP3 predvajalniki, svetilke, digitalni fotoaparati itd.

Izvedite več o tem, kateri elektroliti in elektrode se uporabljajo tudi v teh in drugih vrstah baterij. glede tega, katere vrste opreme so najbolj priporočljive, branje sorodnih člankov več spodaj.
Avtorica Jennifer Fogaça
Diplomiral iz kemije