Baterija gre za sistem, v katerem se kemijska energija spontano pretvori v električno energijo.
Leta 1836 je angleški kemik in meteorolog John Frederic Daniell (1790-1845) zgradil kup, drugačen od takrat znanega: kup Alessandra Volte. Na tem kupu je med seboj povezani dve elektrodi, ki sta bili sestavljeni iz kovine, potopljene v vodno raztopino soli, ki jo tvorijo kationi te kovine.
Ena izmed elektrod, bakrena elektroda, je bila sestavljena iz bakrene plošče, potopljene v raztopino bakrovega sulfata (CuSO4). Druga elektroda je bila cinkova elektroda, sestavljena iz cinkove plošče, potopljene v raztopino cinkovega sulfata (ZnSO4).
Ti dve elektrodi sta bili med seboj povezani z električnim tokokrogom, ki je vseboval žarnico, kajti če bi se vklopila, bi to pomenilo pojav električnega toka.
Prav tako je bil med njima solni most. Ta most je sestavljala steklena cev v obliki črke U, ki je na primer vsebovala koncentrirano vodno raztopino zelo topne soli, kot je kalijev klorid (KCl (aq)). Konci cevi so prevlečeni z bombažem ali agarjem.
Spodaj imamo zgradbo te celice ali elektrokemične celice, ki je postala znana kot Danielova celica. Spomnimo se, da se vsaka elektroda imenuje pol celica.
Ko je vezje zaprto, se svetilka vklopi in čez nekaj časa, cinkova plošča je korodirana in se njena masa zmanjša, medtem ko je bakrena plošča ravno nasprotno, njena masa se poveča (kot je prikazano na spodnji sliki). Ugotovljeno je tudi, da poveča se koncentracija ionov Zn v mol / L2+ in zmanjšanje Cu ionov2+.
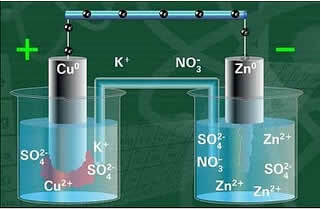
Shema skladov Daniell.
Zakaj se to dogaja?
Ne ustavi se zdaj... Po oglaševanju je še več;)
Da bi razumeli, poglejmo reakcije, ki potekajo na vsaki elektrodi posebej.
V cinkovi elektrodi pride do naslednje ravnotežne reakcije:
Zn (s) ↔ Zn2+(tukaj) + 2 in-
To pomeni, da je kovinski cink (iz plošče) podvržen oksidaciji, to pomeni, da da dva elektrona cinkovemu kationu (iz raztopine) in postane Zn2 +. Prav tako se zgodi nasprotno, cinkov kation, ki je prisoten v raztopini, sprejme dva elektrona, ki ju je daroval cink, in postane kovinski cink. Zato poteka nemoten postopek oksidacije in redukcije.
Enako velja za bakreno elektrodo, ki bo imela globalno reakcijo v dinamičnem ravnovesju: Cu (s) ↔ Cu2+(tukaj) + 2 in-
Daniell je spoznal, da če bo ti dve elektrodi povezal, bo bolj reaktivna elektrone namenila manj reaktivnemu kationu, namesto da bi to storila s kationi v svoji raztopini. V tem primeru je cink najbolj reaktiven in je podvržen oksidaciji, tako da bakrom odda elektrone, zato se njegova masa zmanjša. Elektroda, ki je podvržena oksidaciji, je negativni pol, imenovan anoda. Bakrena elektroda je tista, ki se podvrže redukciji, bakreni kation sprejme dva elektrona iz cinka in se imenuje katoda (pozitivni pol).
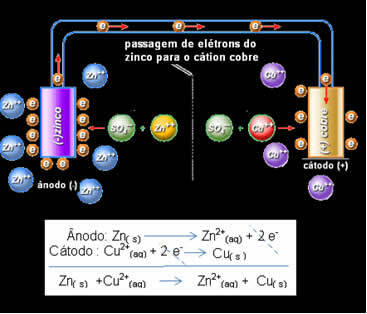
Elektronski prehod in globalna enačba Danielovega sklada.
Zgoraj imamo globalno enačbo za ta kup, ki jo dobimo z dodajanjem dveh polovičnih reakcij. Njegova predstavitev ali kemijski zapis je narejena v skladu z naslednjim pravilom:

Torej za Daniellin sklad imamo:
Zn / Zn2+// Ass2+ / rit
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Brazilska šolska ekipa
Fizikalno-kemijska - Kemija - Brazilska šola
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Danilov kup"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Dostopno 28. junija 2021.


