Nekatere spojine imajo v svoji strukturi dvojne vezi, ki se izmenjujejo z enojnimi vezmi. Najbolj znan med njimi je benzen, katerega zgradbo je leta 1865 predlagal nemški kemik Friedrich August Kekulé (1829-1896). Njegova struktura bi bila ciklična in bi jo tvorile tri dvojne vezi, vpletene v tri enojne vezi, kot je prikazano na spodnjih slikah:
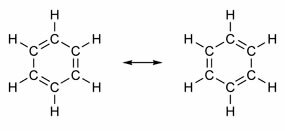
Sprejemljiva sta oba načina predstavljanja benzena, saj je mogoče spremeniti elektrone v π vezicah, ne da bi spremenili položaj atomov. Vendar niti ne predstavlja točno tega, kar je, niti ne pojasnjuje svojega vedenja. Obnašati bi se moral kot alken in sprožiti reakcije dodajanja, vendar se v praksi to ne zgodi. Benzen je precej stabilen in deluje, kot da nima dvojnih vezi; daje substitucijske reakcije kot pri alkanih.
Leta 1930 je ameriški znanstvenik Linus Pauling predlagal resonančno teorijo, ki je pojasnila to očitno protislovje. Ta teorija je rekla:
Ne ustavi se zdaj... Po oglaševanju je še več;)
»Kadar koli lahko v strukturni formuli spremenimo položaj elektronov brez spreminjanja lege atomov, resnično strukturo št ne bo nobena od pridobljenih struktur, temveč a resonančni hibrid teh struktur. "
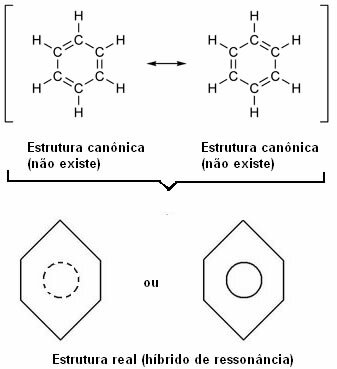
Ta učinek dokazuje velikost ogljikovih vezi in razdalja med njimi. Ta razdalja je vmesna z razdaljo enojne vezi (1,54 Å) in dvojne vezi (1,34 Å); znaša 1,39 Å zaradi resonančnega učinka.
Ta učinek je viden tudi v strukturi molekule ozona (O3), kot je prikazano spodaj:
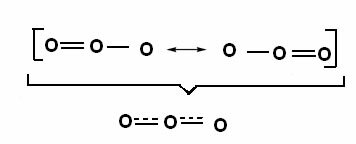
Kanonične strukture in hibridni ozonski resonanci.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Brazilska šolska ekipa.
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Resonanca v kemičnih spojinah"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm. Dostopno 28. junija 2021.



