Kot je prikazano v besedilih "Elektromagnetni spekter kemijskih elementov"in"Emisijski in absorpcijski spektri in Kirchhoffovi zakoni", Spektri diskontinuiranih emisij vsakega kemičnega elementa so različni.

Torej, spodaj imamo ločene spektre nekaterih od teh elementov:

Tako je danski fizik Niels Böhr (1885-1962) spoznal, da je to lahko povezano s strukturo atoma vsakega od teh elementov. Zato je predlagal atomski model, ki je dopolnil Rutherfordov model, vendar se je osredotočil na obnašanje okoliških elektronov v jedru atoma.
Nekaj časa prej je Max Planck (1858-1947) predlagal teorijo, da so elektroni kvantizirano, v smislu, da oni oddajajo in absorbirajo določene količine energije, kot da bi šlo za majhne zavojčke energije, ki ga je poklical koliko (kvantna, v ednini).
Tako je Böhr predlagal naslednje: ker ima vsak element drugačen spekter, ima vsak element v svojem atomu elektrone konstantne in različne energije od elementa do elementa.
Vsak elektron lahko ostane samo v določeni določeni orbiti, saj ima na vsaki od teh tir konstantno, natančno določeno in značilno energijo. Elektron lahko zaseda le tiste ravni energije, za katere ima ustrezno energijo.
Spektri so prekinjeni, ker so elektroni kvantizirani.
Elektron lahko spreminja nivo le, če absorbira energijo. Na primer, ko kurite natrijevo sol v gorilniku Bunsen, dovajate energijo elektronom. Ko absorbira kvant energije, elektron skoči na drugo bolj energijsko raven in ostane v vznemirjenem stanju. Vendar je osnovno stanje bolj stabilno, zato ta elektron odda absorbirano energijo in se vrne v prvotno orbito. To energijo oddaja v obliki elektromagnetnih valov, ki jih je mogoče vizualizirati v obliki svetlobe. Pri natriju je ta svetloba intenzivno rumene barve. Ko torej ti valovi prehajajo skozi prizmo, dobimo prekinitveni spekter natrija.
Torej, za Böhra vsaka svetlobna črta, ki se je pojavila v prekinitvenem spektru elementov, je označevala energijo, ki se je sprostila, ko se je elektron vrnil z ene zunanje ravni na drugo, ki je bližje jedru.
Spodnja slika pomaga bolje razumeti to težavo:
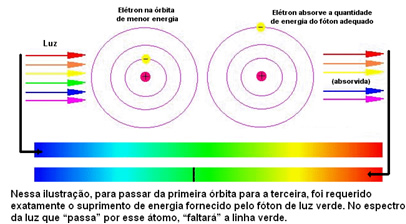
Ker so atomi vsakega elementa dovoljene le določene energijske vrednosti, ki ustrezajo energijskim slojem, je za vsak element različen spekter.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm

