Kovalentna vez se pojavi, ko si dva atoma izmenjujeta pare elektronov, da dobita elektronsko konfiguracijo an žlahtni plin (z 8 elektroni v valentni lupini ali z 2, v primeru tistih s samo K lupino), v skladu s pravilom oktet.
Vendar obstajajo posebni primeri kovalentnih vezi, v katerih skupni elektronski par prihaja samo iz enega izmed atomov, ki je že stabilen. Prej se je imenovala ta vrsta kovalentne vezi dativ, danes se bolj pogosto imenuje koordinirati.
Oglejte si nekaj primerov, da boste razumeli, kako se to zgodi:
- CO (ogljikov monoksid):
Ogljik ima v svoji valentni lupini 4 elektrone. Zato mora po pravilu okteta, da je stabilen, sprejeti še 4 elektrone, skupaj 8. Po drugi strani ima kisik v valentni lupini 6 elektronov in mora sprejeti 2 elektrona, da dobi konfiguracijo neona plemenitega plina.
Torej, najprej imata ogljik in kisik dva para elektronov, tako da je kisik stabilen:
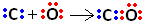
Vendar ogljik ostaja nestabilen, saj ima še vedno 6 elektronov in potrebuje 2. Zato kisik, ki je že stabilen, deli enega od svojih parov elektronov z ogljikom, to pomeni, da z njim naredi zvezo, zaradi česar je stabilen:

Upoštevajte, da lahko koordinatno kovalentno vez predstavimo s pomišljajem, tako kot običajno kovalentno vez.
- SAMO2 (Žveplov dioksid):
Vsak atom žvepla in kisika ima po 6 elektronov v valentnih lupinah, zato morajo sprejeti po 2 elektrona. Sprva žveplo tvori dve skupni kovalentni vezi in si delita dva para elektronov z enim od atomov kisika, oba pa ostaneta stabilna z 8 elektroni.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Toda drugi atom kisika ni stabilen, zato si žveplo deli par svojih elektronov prek usklajene ali dativne kovalentne vezi:
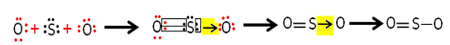
Upoštevajte, da imamo v tem primeru tri atome v molekuli, zato lahko pride do migracije vezi z enega atoma na drugega. Molekulo žveplovega dioksida lahko predstavimo tudi tako: O ─ S ═ O.
Temu pravimo pojav vezi resonanca. Oglejte si še tri primere v spodnji tabeli:
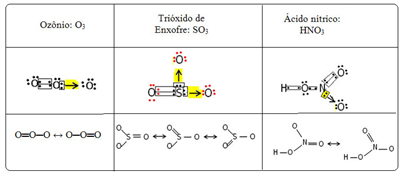
Pokličejo se možne strukture resonančne strukture ali kanonične oblike.
Ta vrsta vezi se pojavlja tudi pri tvorbi ionov, tako kot pri hidronijevih ionih (H3O+) in amonija (NH4+).
Najprej kation H+ nastane, ko vodik izgubi en sam elektron in mu ostane pozitiven naboj. Torej bo treba sprejeti dva elektrona, da bosta stabilni. To se zgodi prek dativne vezi z vodo (v primeru hidronijevega iona) in z amoniakom (v primeru amonijevega iona). Pazi:

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Dativna ali usklajena kovalentna vezava"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm. Dostopno 28. junija 2021.


