Študija moči a kislina je zelo pomemben za določanje sposobnosti kisle raztopine za vodenje električnega toka, saj se to nanaša na količino ionov, ki jih ta snov tvori v stiku z vodo (ionizacija). Kadar je kislina premočna, tvori preveč hidronijevih kationov (H3O+) in veliko anionov (X-). Glej enačbo ionizacije bromovodikove kisline:
HBr + H2O → H3O+ + Br-
Pri ionizaciji vodik, ki je prisoten v molekuli kisline, sodeluje z molekulo vode in tvori hidronij. Da pa se lahko zgodi ta dogodek, mora biti atom vodika nujno ioniziran. Ionizabilni vodik je tisti, ki lahko tvori hidronijev kation.. Da bi ugotovili, ali je vodik ioniziran, upoštevamo razvrstitev kisline kot hidracidne (v svoji sestavi nima kisika) ali oksokislinske (ima kisik v svoji sestavi).
a) Hidracidi
Ves vodik v hidracidi se šteje za ionizirajoč.
Primeri:
- HCl: vodik, ki se lahko ionizira, s čimer nastane hidronij;
Ne ustavi se zdaj... Po oglaševanju je še več;)
- H2S: Dva vodika, ki se lahko ionizirata, nato tvorita dva vodika
b) oksidna kislina
V oksidni kislini ionizira se le vodik, ki je v molekuli vezan na atom kisika. Za to je treba zgraditi njegovo strukturno formulo. Oglejte si nekaj primerov:
H3PRAH4 (fosforna kislina)
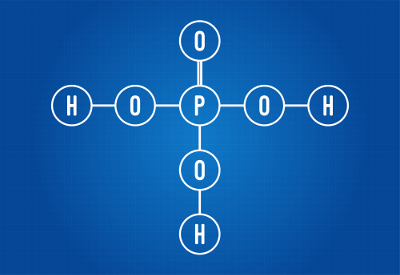
Strukturna formula fosforne kisline
Vidimo lahko, da so v strukturi fosforne kisline trije vodiki, vezani na kisik, torej trije vodiki, ki jih je mogoče ionizirati. Enačba ionizacije bo:
H3PRAH4 + 3 H2O → 3 H3O+ + PO4-3
H2SAMO4 (žveplova kislina)
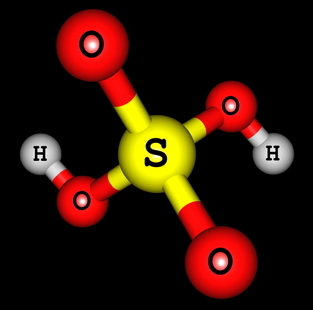
Strukturna formula žveplove kisline
Vidimo lahko, da sta v strukturi žveplove kisline dva vodika, vezana na kisik, torej dva vodika, ki se lahko ionizirata. Enačba ionizacije bo:
H2SAMO4 + 2 H2O → 2 H3O+ + OS4-2
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Ionizirajoči se vodiki"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/hidrogenios-ionizaveis.htm. Dostopno 28. junija 2021.
Kemija

Disocijacija in ionizacija, italijanski znanstvenik Volta, električni tok, švedski fizikalni kemik Svant August Arrhenius, teorija Arrhenius, pozitivni ioni, kationi, negativni ioni, anioni, kavstična soda, kuhinjska sol, polarne molekule, disociacija ionski,