Kot že ime pove, med ioni pride do ionske vezi. Ker imajo nasprotne naboje, se kationi (element s pozitivnim nabojem) in anioni (element z negativnim nabojem) elektrostatično privlačijo in tvorijo vez. Vendar ionsko trdno snov sestavlja aglomerat kationov in anionov, organiziranih z natančno določenimi geometrijskimi oblikami, imenovanimi rešetke ali kristalne rešetke.
Na primer, sol (natrijev klorid) nastane z dokončnim prenosom elektrona iz natrija v klor, kar povzroči nastanek natrijevega kationa (Na+) in kloridni anion (Cl-). V praksi ta reakcija ne vključuje le dveh atomov, temveč ogromno in nedoločeno število atomov, ki tvorijo kristalno mrežo v obliki kubika, kot je prikazano spodaj:
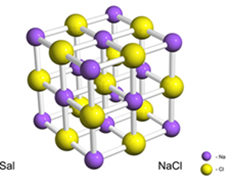
Če kristale soli pogledamo z optičnim elektronskim mikroskopom, bomo videli, da so zaradi svoje notranje strukture dejansko kubični.

Ker je vsaka ionska spojina nato sestavljena iz nedoločenega in zelo velikega števila ionov, kako lahko predstavljamo ionsko spojino?
Običajno se uporablja formula formula enote
, ki je tisti, ki predstavlja delež, izražen z najmanjšim možnim številom kationov in anionov, ki tvorijo kristalno mrežo, tako da se celotni naboj spojine nevtralizira. Da bi se to zgodilo, je potrebno, da je število elektronov, ki se jim daje atom, enako številu elektronov, ki jih prejme drugi atom.Pomembni so nekateri vidiki enotne formule ionskih spojin, glejte nekatere:
Ne ustavi se zdaj... Po oglaševanju je še več;)
- Vedno najprej napiši kation in nato še anion;
- Ker je vsaka ionska spojina električno nevtralna, posameznih ionskih nabojev ni treba zapisovati;
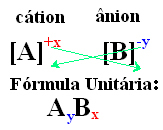
- Številke indeksa, ki se pojavijo na desni strani vsakega iona, označujejo razmerje med atomi kationa in anionom. Te številke se imenujejo indeksi in številka 1 ni zapisana.
Na primer, v primeru natrijevega klorida imamo, da je njegova enota formula NaCl, saj imamo natančno 1 natrijev kation za vsak kloridni anion.
Glej še en primer, Al3+ ima tri pozitivne naboje, medtem ko ima F- ima le enega negativnega, zato so za nevtralizacijo spojine potrebni trije fluoridni anioni. Tako sklepamo, da je njegova enota formula AlF3.
Enostaven način, kako priti do formule enote ionske spojine, je zamenjava njenih nabojev za njene indekse, kot je prikazano spodaj na splošno:
Primeri:

Druga formula, ki se uporablja za predstavitev ionskih snovi, je Lewisova formula ali elektronska formula, kaj predstavlja elektrone iz valentne lupine ionov "kroglic" okoli simbola elementa. V primeru soli imamo:

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Formule za zastopanje ionskih obveznic"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. Dostopno 28. junija 2021.
b) Določite vrednost x v formuli za natrijev aluminijev fluorid.
Jonske spojine, glavne značilnosti ionskih spojin, vezava med ioni, dokončen prenos elektronov, elektrostatične privlačne sile med ioni, negativnimi in pozitivnimi ioni, anioni, kationi, ionska vez, molekularna struktura on
Ogljikova prostorska formula, Lewisova elektronska formula, ravninska struktura, elektronski pari, vez kovalentna, valentna plast, razvoj atomskega modela, molekulska formula, strukturna formula, formule tridimenzionalni.
Kemijske formule, ravna strukturna formula, Couperjeva strukturna formula, trojna vez, plin dušik, elektronska formula, Lewisova formula, molekulska formula, enojna vez, dvojna vez, plin ogljikov.
Kemija

Jonska vez, dogovori med ionskimi spojinami, ionskimi aglomerati, natrijevim kloridom, kuhinjsko soljo, ionsko snovjo, elektrostatične privlačne sile, kloridni anioni, natrijevi kationi, polarna topila, pozitivni ioni, kationi, negativni ioni, anioni.


