Elektroliza je postopek, ki ga kemijska industrija pogosto uporablja, saj omogoča pridobivanje snovi, ki jih v naravi ni, kot so klor, jod, kavstična soda drugi.
Elektroliza je nasprotje celice, v kateri se električna energija pridobiva z redoks reakcijami, torej kemična energija se pretvori v električno energijo. Že pri elektrolizi se elektrika uporablja za proizvodnjo redoks reakcij in kemične energije.
Od tod tudi izvor njegovega imena elektro pomeni "električni tok" in liza pomeni "odmor". Prav to se zgodi, električni tok zlomi ali razgradi snov, ki ji je izpostavljena.
Baterija je spontani proces, elektroliza pa to je ne-spontan proces, ki ga je treba zagnati s pomočjo električnega toka.
Obstajata dve vrsti elektrolize: a ognjeno in v vodnem mediju. V tem besedilu bomo obravnavali prvi primer.
Razlika med magmatsko elektrolizo in elektrolizo v vodnem mediju je v obliki, v kateri je snov, ki bo izpostavljena električnemu toku. V primeru magmatske elektrolize je ionska snov v tekočem stanju, to je staljena, brez prisotnosti vode.
Beseda "ognjeni" prihaja iz latinščine ognjeno, kar pomeni »pekoč, vnet«.Pri elektrolizi se uporablja posoda, ki se imenuje a Kuba ali elektrolitska celica, kjer sta nameščeni dve elektrodi, skozi katero bo prehajal električni tok. Elektrode so lahko inerten (med elektrolizo se ne spreminjajo) oz aktivno (Med elektrolizo trpijo za nekakšno spremembo). Najbolj uporabljene so inerte iz platine ali grafita.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Nato se elektrode priključijo na vir enosmernega toka (celica ali baterija). Negativni pol akumulatorja bo oskrboval z elektroni eno od elektrod, postal bo negativno napolnjen in bo pritegnil kation (pozitivne ione) iz staljene snovi. Ker privlači katione, se ta negativna elektroda imenuje katoda. V njej kationi sprejemajo elektrone in se reducirajo.
Pozitivna elektroda privlači anione (negativne ione) in se zaradi tega imenuje anoda. Anioni izpraznijo svoje elektrone na anodi in so pod oksidacijo.
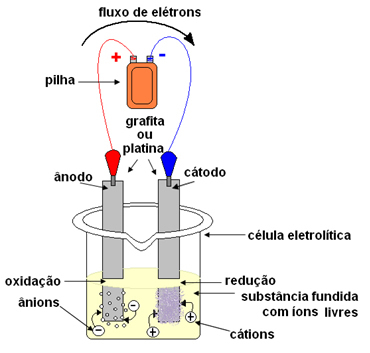
V baterijah se pozitivna elektroda imenuje katoda, negativna pa anoda. Tu je pri elektrolizi ravno nasprotno, anoda je pozitivni pol, katoda pa negativni pol. Vendar pa v obeh primerih v akumulatorju in pri elektrolizi na anodi pride do oksidacije, na katodi pa do redukcije.
Na kratko imamo:

Drugo pomembno dejstvo je, da mora imeti celica ali baterija, ki se uporablja za ustvarjanje električnega toka, ddp (potencialna razlika) enaka ali večja od reakcijske potencialne razlike.
Če želite bolje razumeti, kako poteka postopek elektrolize in kako razgrajuje snovi, ki tvorijo pomembne elemente, ali preproste snovi, preberite besedilo Magnetna elektroliza natrijevega klorida.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Magmatska elektroliza"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea.htm. Dostop 27. junija 2021.
d) Elektroliza je spontana redoks reakcija.
Kemija

Uporaba elektrolize, galvanizacije, nikljanja, kromiranja, niklja, kroma, katode, natrija, aluminija, klora, kavstična soda, vodikov plin, magmatska elektroliza, vodna elektroliza, alkalne kovine, zemeljska alkalija, plin klor.
Kemija

Elektroliza, raztopine elektrolitov, električni tok, oksidacijsko-redukcijske reakcije, spontani kemični postopek, kemijski postopek nespontano, transformator, umetna preobrazba, industrije, alkalijske kovine, alkalna zemlja, plin vodik, plin kl
