Po mnenju francoskega kemika Henryja Louja Le Chatelierja premik ravnotežja gre za situacijo, v kateri se kemijska reakcija premakne (naprej ali nazaj), kadar je izpostavljena zunanjim motnjam. Ta izjava, ki jo je predlagal kemik, je postala znana kot načelo Le Chatelierja.
Opomba: neposredna reakcija je tista, pri kateri se reaktanti pretvorijo v produkte, medtem ko je inverzna reakcija tista, pri kateri se produkti spremenijo v reaktante.
Reakcija je v ravnovesju, ko je hitrost neposredne reakcije enaka obratni reakciji, to je reaktanti se spremenijo v izdelke z enako hitrostjo, kot se proizvodi spremenijo v reaktante.

Splošni prikaz ravnotežne kemične reakcije
V skladu z načelom Le Chatelierja kadar koli sila deluje na ravnotežno reakcijo, premik ravnotežja zgodilo se bo, da bi to motnjo izničilo in vzpostavilo novo ravnotežno situacijo v reakciji.
Motnje zmožne premakniti kemično ravnovesje so:
→ sprememba koncentracije
ko koncentracija snovi (v mol / l ali molarjih) udeleženca v reakciji se spremeni (zmanjša ali poveča), premik ravnotežja, dokler udeleženec ni v trdnem stanju.
Tako je v skladu z načelom Le Chatelierja, če koncentracija če se udeleženec poveča, se ravnotežje premakne v nasprotni smeri povečanja. Če pa koncentracija udeleženec se zmanjša, prišlo bo do premika tehtnice v smeri zmanjšanja. Na primer:

Splošni prikaz ravnotežne kemične reakcije
Povečanje koncentracije A = ravnotežje se premakne v desno
Zmanjšanje koncentracije B = tehtnica se premakne v levo
→ Sprememba pritisk
Nihanje tlaka samo spodbuja premik v ravnovesju ki imajo plinaste sestavne dele, saj ko je povečan, molekule povečajo trke med seboj, ko pa se tlak zmanjša, zmanjšajo trke med seboj.
Trki med molekulami se povečujejo z naraščanjem pritisk, ker se glasnost (prostor) temu primerno zmanjša, hkrati pa zmanjša pritisk spremlja vse večja glasnost.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Opomba: V kemijskem ravnotežju analiza učinka spremembe tlaka upošteva molsko prostornino reaktantov in produktov, ki je povezana s koeficienti reakcije. V spodnji enačbi je volumen reagenta 4 in produkt 2.
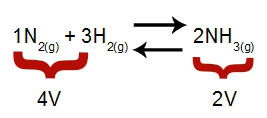
Enačba, ki označuje količine, prisotne pri tvorbi amoniaka
V skladu z načelom Le Chatelierja, če se pritisk sistema poveča, se premakne ravnotežje v smeri večje prostornine, če pa se tlak zniža, pa premik ravnovesje.

Enačba, ki predstavlja ravnotežje nastajanja amoniaka
Povečanje tlaka = ravnotežje se premakne v desno (ker je to stran z manj prostornine).
Zmanjševanje tlaka = ravnotežje se premakne v levo (ker je to stran večje glasnosti).
→ Nihanje temperature
Povečanje temperatura ravnotežne reakcije daje prednost molekulam, da se bolj spopadajo, medtem ko zmanjšanje temperaturazmanjša njihovo vznemirjenost in posledično šoke. Ker je povišanje temperature vedno naklonjeno reakciji endotermni (tisti, ki absorbira energijo).
Analiza vpliva temperature na ravnotežje v glavnem upošteva ΔH reakcije. Če je ΔH pozitiven, bo reakcija naprej endotermna, povratna pa eksotermna. Če je ΔH negativna, bo desna eksotermna, inverzna pa endotermna.
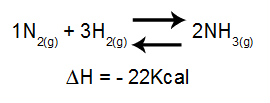
Enačba, ki vsebuje spremembe entalpije v tvorbi amoniaka
Povečanje temperature = ravnotežje se premakne v levo (ker je to smer endotermne reakcije, saj je ΔH negativno).
Znižanje temperature = ravnotežje se premakne v desno (ker je to smer eksotermne reakcije, saj je ΔH negativno).
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je ravnotežni premik?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm. Dostopno 28. junija 2021.

