THE уравнение клапейрона математическое выражение, которое связывает такие величины, как давление (P), объем (V), температура (T) и количество частиц (n), составляющих идеальный или идеальный газ. Это уравнение названо в честь французского физика. ПавелЭмильклапейрон и может пониматься как обобщение эмпирических законов газыидеальновГей-Люссак, Шарль и Бойль. Он имел фундаментальное значение для изучения идеальных газов и позволил эволюционировать Тепловые машины, что делает их все более и более эффективными за последние несколько десятилетий.
Смотрите также: Открытия в физике, произошедшие случайно
Уравнение Клапейрона: закон идеального газа
Уравнение Клапейрона: полученный из трех эмпирических законов, то есть законы, которые были определены из экспериментов. Такие законы объясняют поведение газов в газовые преобразованияизоволюметрический (Закон Гей-Люссака), изобарический (Закон Чарльза) и изотермы (Закон Бойля). Согласно этим законам:
в преобразованиях изоволюметрическийсоотношение между давлением и термодинамической температурой идеального газа остается постоянным;
в преобразованиях изобарический, соотношение между объемом и термодинамической температурой идеального газа постоянно;
- в преобразованиях изотермы, произведение давления и объема идеального газа остается постоянным.
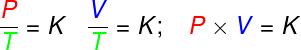
п - давление (Па - паскаль)
V - объем газа (м³)
Т - термодинамическая температура газа (К - кельвин)
Из трех приведенных выше законов уравнение Клапейрона определяет, какое значение постоянный (K) полученные в каждом из перечисленных преобразований. Согласно уравнению Клапейрона, эта постоянная равна количеству молей, умноженному на постоянная R, известная как универсальная постоянная идеальных газов и равная Постоянная Больцмана умножается на Число Авогадро.
Формула
Ознакомьтесь с формулой, известной как уравнениевКлапейрон:
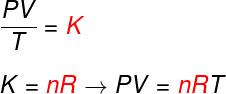
нет - количество молей (моль)
р - универсальная постоянная идеальных газов (R = 0,082 атмл / моль. K или 8,314 Дж-моль / К)
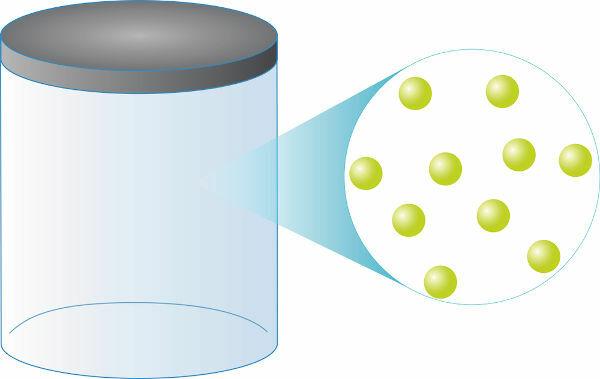
Анализируя уравнение Клапейрона, можно увидеть, что давление проявляется идеальными газами прямо пропорционально температуре а также к количество родинок. Более того, давление обратно пропорционально объему занят газом.
О модель идеального газа стало возможным благодаря уравнению Клапейрона, широко используется для разработка машин на базе жидкости, такие как паровые машины и двигатели внутреннего сгорания.
Несколько важных результатов можно было получить из уравнения Клапейрона. Один из них, например, предсказывает, что 1 моль любого идеального газа занимает объем 22,4 л под давлением 1 атм (1,01.105 Па) и при температуре 273 тыс. (0 ° С).
Смотрите также: Важнейшие понятия термологии
Решенные упражнения на уравнение Клапейрона
Вопрос 1 - (UECE) Газ, температура, объем и давление которого могут быть связаны соотношением PV = nRT, имеет следующие характеристики:
а) очень большое среднее расстояние между молекулами, чтобы не учитывать межмолекулярные взаимодействия, кроме случаев столкновения; молекулы испытывают упругие столкновения.
б) очень маленькое среднее расстояние между молекулами; молекулы испытывают неупругие столкновения.
в) очень большое среднее расстояние между молекулами, чтобы не учитывать межмолекулярные взаимодействия, за исключением столкновений; молекулы испытывают неупругие столкновения.
г) очень большое среднее расстояние между молекулами и с сильными межмолекулярными взаимодействиями; молекулы испытывают упругие столкновения.
разрешение:
В модели идеального газа большое количество безразмерных частиц движется с большой скоростью в случайных направлениях. Единственное взаимодействие, которому подвергаются эти частицы, - это совершенно упругие столкновения, поэтому правильной альтернативой является буква А.
Вопрос 2 - (UFRGS) Рассмотрим следующие утверждения об идеальных газах.
Я. Константа R, присутствующая в уравнении состояния для газов pV = nRT, имеет одинаковое значение для всех идеальных газов.
II. Одинаковые объемы различных идеальных газов при одинаковой температуре и давлении содержат одинаковое количество молекул.
III. Средняя кинетическая энергия молекул идеального газа прямо пропорциональна абсолютной температуре газа.
Какие из них правильные?
а) Только я
б) Только II
в) Только III
г) Только I и II
д) I, II и III
Шаблон:
Давайте посмотрим на альтернативы:
Я. верный, отсюда ее называют универсальной постоянной идеальных газов.
II. верный. Согласно уравнению Клапейрона, если два идеальных газа имеют одинаковое давление, температуру и объем, то количество частиц в этих газах одинаково.
III. верный. Согласно теореме о равнораспределении энергии, кинетическая энергия частиц в идеальном газе пропорциональна его температуре.
Следовательно, правильная альтернатива - это буква е.
Вопрос 3 - (UFJFТакие люди, как Клапейрон, Бойль, Мариотт, Гей-Люссак, ван дер Уоллс и другие, провели важные исследования, касающиеся свойств газов. Поведение реальных газов приближается к идеальным газам в условиях низкого давления, а также к газам, содержащимся в большом объеме, и газам, выдерживаемым при высоких температурах. Учтите, что в лабораторном эксперименте емкость объемом V полностью закрыта и содержит 1 моль идеального газа под давлением 4,0 атм подвергается расширению при постоянной температуре, равной 127 ° C, и этот газ ведет себя как идеальный газ, как показано на графический.
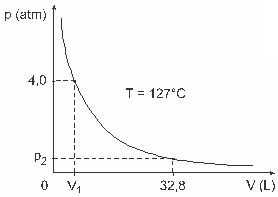
В этом случае, когда газ занимает объем, равный 32,8 л, оказываемое им давление будет:
(Дано: универсальная постоянная идеальных газов R = 0,082 атм. Л / моль. К.)
а) 0,32 атм
б) 0,40 атм
в) 1,0 атм.
г) 2,0 атм
д) 2,6 атм
разрешение:
Письмо C.
Чтобы решить это упражнение, нам нужно применить данные к уравнению Клапейрона, но перед этим нам нужно преобразовать температуру, выраженную в градусах Цельсия, в градусы Кельвина. Проверить:

Рафаэль Хеллербок
Учитель физики
Источник: Бразильская школа - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm