Американский химик Гилберт Н. Льюис (1875-1946) предложил правило октетов, которое гласит:
"Атомы различных элементов устанавливают химические связи, отдавая, получая или разделяя электроны, чтобы получить электронную конфигурацию благородный газ, то есть с 8 электронами в последней оболочке (или с 2 электронами в случае тех атомов, которые имеют только одну электронную оболочку, как это происходит с водород) ".
В 1916 году Льюис предположил, что, чтобы оставаться стабильными, достигая октета или дуэта, элементы, составляющие молекулярные вещества выполнить обмен электронными парами. Эти вещества образованы только атомами водород, неметаллы и полуметаллы, все с склонность получать электроны. Следовательно, ни один из них не может отдать электрон (как это происходит с металлами с ионными связями), но каждый должен получать, поэтому они делятся своими электронами ковалентной связью или молекулярный.
Таким образом, Гилберт Льюис предложил способ представления ковалентной или молекулярной связи, который стал известен как
Формула Льюиса. Ее еще называют электронная формула или еще, Электронная формула Льюиса, потому что его главная особенность в том, что он показывает электроны в валентной оболочке каждого атома и образование электронных пар.Каждый электрон представлен точкой., который окружает символ соответствующего химического элемента. Вокруг элемента находятся только электроны валентной оболочки.
Как показано в таблице ниже, чтобы узнать количество электронов в валентной оболочке, достаточно знать семейство периодической таблицы:
Не останавливайся сейчас... После рекламы есть еще кое-что;)

В формуле Льюиса каждая общая электронная пара представляет собой химическую (ковалентную) связь, где электроны встречаются в области электросферы, общей для каждой пары атомов, соединенных вместе. Поэтому на изображении они размещены рядом.
Например, давайте выясним, что представляет собой формула Льюиса для газообразного водорода, молекулярная формула которого: H2.
Каждый атом водорода имеет только один электрон в валентной оболочке, так как этот элемент принадлежит к семейству 1 Периодической таблицы. Каждый должен получить еще один электрон, чтобы быть стабильным, с двумя электронами в K-электронной оболочке. Итак, они делятся своими электронами, и оба получают по два. Посмотрите:
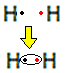
Это формула Льюиса для молекулы газообразного водорода.
Кислород имеет шесть электронов в своей электронной оболочке, поэтому каждый должен получить еще два электрона, чтобы быть стабильным, с восемью электронами. Следовательно, формула Льюиса для молекулы газообразного кислорода имеет следующий вид:

Посмотрите, что есть две ссылки, так как есть две общие пары.
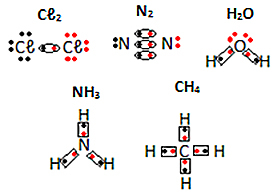
Смотрите другие примеры электронных формул молекулярных веществ ниже:
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Электронная формула Льюиса»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. Доступ 28 июня 2021 г.
Пространственная формула углерода, электронная формула Льюиса, плоская структура, электронные пары, связь ковалентный, валентный слой, эволюция атомной модели, молекулярная формула, структурная формула, формулы трехмерный.
Химические формулы, плоская структурная формула, структурная формула Купера, тройная связь, газ азот, электронная формула, формула Льюиса, молекулярная формула, одинарная связь, двойная связь, газ углекислый.
Химия
Молекулярные вещества, температура кипения, контактная поверхность, точка кипения, силы межмолекулярного притяжения, химическая связь, молекулярные соединения, ковалентные химические связи, ионные связи, металлические связи, физические состояния Плохо

