THE соляной мост был предложен английским химиком Фредериком Даниэлем в 1836 году, когда этот ученый создал аккумулятор назван в его честь (Данилова куча). этот мост представляет собой U-образную трубку с двумя пористыми концами. (состоящий из хлопка или агар-агара) и содержит водный раствор, образованный водой и солью. Он косвенно связывает растворы двух полуэлементов ячейки (анода и катода).
Наблюдение: Анод - это отрицательный полюс батареи, где происходит окисление, а катод - это положительный полюс, где происходит восстановление.
Чтобы понять важность соляного моста, изначально необходимо понять принцип действия сваи. См. Схему ниже:
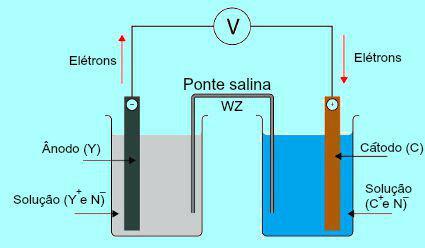
Общая схема стека Даниэля
Первоначально металл (Y) пластины, находящейся в аноде, подвергается окислению. При окислении металл превращается в катион, который попадает в раствор, в котором находится пластина. По этой причине в анодном растворе появляется повышенная концентрация катионов (Y+). В этом случае наблюдается уменьшение металлической пластины анода.
Y → и- + Y+
Затем электроны, потерянные во время окисления металла анодной пластины, проходят через внешний электрический провод и попадают на металлическую пластину, присутствующую в катоде. Таким образом, пластина, присутствующая у катода, заряжается электронами.
-
Присутствующие катионы (C+) в растворе движутся к катодной пластине, поскольку она заряжена электронами. Катионы, приобретая электроны, присутствующие в пластине, становятся нейтральными (стабильными и твердыми) и прилипают к ней. По этой причине в катодном растворе концентрация анионов выше, чем катионов. В этом случае наблюдается увеличение размеров металлической пластины катода.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Ç+ + и- → С
Из понимания того, как Куча Даниэля, можно заметить, что раствор, присутствующий в аноде, получает большее количество катионов Y+ из-за окисления металла пластины X. С другой стороны, раствор, присутствующий в катоде, теряет свои катионы (C+), потому что они страдают от уменьшения зубного налета.
Именно по этому вопросу освещается работа соляного моста. Основная функция этого моста - поддерживать баланс зарядов, присутствующих как в анодном, так и в катодном растворах. В солевом мостике у нас всегда есть соль (обычно хлорид калия или нитрат аммония), диссоциированная в воде. См. Представление уравнения в солевом мостике:
WZ + H2O → W+ + Z-
В солевом мостике есть два иона (W+ и Z-), которые смещены на катод и анод согласно:
) Анод получает анионы (Z-), присутствующий в солевом мостике из-за окисления элемента (Y), что вызывает увеличение количества катионов (Y+) в растворе.
Б) Катод получает катионы (W+) солевого мостика, потому что во время работы от батареи катион (C+), присутствующее в растворе, уменьшается на плате. Таким образом, в катодном растворе больше анионов (N-) и, следовательно, получает катион, присутствующий в солевом мостике.
Автор: Диого Лопес Диас
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
ДНИ, Диого Лопес. «Парусный мостик»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Доступ 28 июня 2021 г.
