Кислоты вещества, которые ионизировать в водной среде и хороши проводники мощность. Кислотность вещества может быть измерена с помощью методов измерения ионного потенциала водорода (pH) решения. Некоторые аналитические методы pH используют индикаторы, такие как лакмус или фенолфталеин, которые отражают значение pH раствора в цвете.
Кислоты можно охарактеризовать:
по наличию или отсутствию кислорода в его молекуле;
силой;
ионизируемыми атомами водорода;
своей волатильностью.
Читайте тоже:Сравнение кислот и оснований - различия и свойства
Характеристики кислот
Они ионизируются в водной среде, высвобождая катион H.+.
Они являются проводниками электричества за счет выброса ионы в водной среде.
При контакте с основной средой они страдают реакция нейтрализации, образуя соль и воду как продукты этой реакции.
Они изменяют цвет раствора в присутствии индикаторного вещества, такого как лакмус или фенолфталеин.
Кислый вкус лимона, апельсина и других цитрусовых обусловлен кислотой, присутствующей в этих продуктах.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Водородный потенциал (pH)
Потенциал ионов водорода (pH) - это расчет, который выражает концентрация ионов водород в определенном решение. Для определения pH и анализа среды учитывается следующее:
Закон разбавления Оствальда (чем больше разбавлено, тем больше ионов образуется в растворе);
автоионизация воды (Kw), которая представляет собой естественный распад молекулы H2O в ионах H+ и ох-;
дистиллированная вода при 25 ° C имеет автоионизацию Kw = 10-14 и такая же концентрация ионов H+ и ох-, то есть это нейтральная среда.
Для расчета pH с учетом концентрации H+, использовать: pH = -log [H+].
Знайте, что:
pH> 7 → щелочной раствор
pH <7 → кислый раствор
pH = 7 или pH = pOH → нейтральный раствор
Смотрите также: На что похожи кислотные формулы?

Классификация кислот
THE классификация кислот можно сделать с учетом четырех различных критериев.
Степень ионизации (α) или сила кислоты
α = количество ионизированных молекул
количество растворенных молекул
Сильные кислоты: α ≥ 50%.
Пример: áкислота серный (ЧАС2ТОЛЬКО4) → α = 61%.Полусильные или умеренные кислоты: 5% < α < 50%.
Пример: фосфорная кислота (H3ПЫЛЬ4) → α = 27%.Слабые кислоты: α ≤ 5%.
Пример: борная кислота (H3BO3) → α = 0,075%.
→ Количество ионизируемого водорода
одноосновная кислота: высвобождает катион H+.
Пример: áкислота соляной (HCL);
двухосновная кислота: высвобождает два катиона H+.
Пример: сероводород (H2S).Triacid: высвобождает три катиона H+.
Пример: борная кислота (H3BO3).тетрацид: высвобождает четыре катиона H+.
Пример: пирофосфорная кислота (H4п2О7).
Внимание! В случае гидрокислот все атомы водорода в молекуле ионизируются; но в случае оксикислот ионизируются только атомы водорода, связанные с атомом кислорода. Примером может служить гипофосфористая кислота (H3ПЫЛЬ2), которая является одноосновной кислотой, потому что, несмотря на то, что в ее составе три атома водорода, она выделяет только водород, связанный с кислород.
→ Наличие кислорода
оксикислоты: имеют в своей структуре кислород.
Пример: хлорноватистая кислота (HO Cl).
Гидрациды: не имеют в своем составе кислорода.
Пример: плавиковая кислота (HF).
→ Волатильность
Фиксированный: точка кипения(СТОПА) > 100 ° C, медленно переходит в газообразное состояние.
Пример: серная кислота (H2ТОЛЬКО4) → PE = 340 ° C.летучие вещества: температура кипения <100 ° C, быстро и легко переходит в газообразное состояние.
Пример: сероводород (H2S) → PE = -59,6 ° C.
Номенклатура кислот
→ Гидрациды
Кислота + название аниона + водород
Для всех кислот термин «кислота» используется перед номенклатурой, характеризующей молекулу. В гидрокислотах суффикс «eto» в названии элемента заменяется на «hydric».
Примеры:
HCl → кислота хлоргидрик
HBr → кислота бромгидрик
ВЧ → кислота фторгидрик
→ оксикислоты
Номенклатура оксикислот варьируется в зависимости от степень окисления (NOX) центрального элемента. См. Таблицу ниже:
NOX центрального элемента |
Номенклатура кислот |
||
приставка- |
-infix- |
-суффикс |
|
+1 и +2 |
Бегемот- |
-анион имя- |
-oso |
+3 и +4 |
-- |
Название аниона |
-oso |
+5 и +6 |
-- |
Название аниона |
-IC |
+7 |
За |
-анион имя- |
-IC |
Примеры:
HClO → Зная, что водород (H) обычно имеет NOX +1, а кислород (O) имеет NOX -2, для того, чтобы у нас была молекула с зарядом 0, хлор (Cl) должен иметь NOX +1, поэтому номенклатура этой кислоты хлорноватистая кислота.
HNO2 → азотистая кислота
HClO4 →áкислотахлорная
→ Исключения из правила
H2CO3 → угольная кислота, и не углеродистые, как это было бы в соответствии с правилом NOX.
ЧАС3BO3 → áкислота борный, и не скучно.
Кислоты в повседневной жизни
Удобрения и лекарства: Фосфорная кислота (H3ПЫЛЬ4) широко используется при производстве удобрений, а также как лекарство. Это одна из нескольких кислот, которые используются в фармацевтической области.
Цитрусовые: имеют аскорбиновую кислоту (C6ЧАС8О6), также известен как Витамин C.
Уксус: имеет в своем составе Уксусная кислота (CH3COOH).
- Газированная вода и безалкогольные напитки: состоит из угольной кислоты (H2CO3), что придает продукту ощущение свежести.
Также доступ:Роль кислот в безалкогольных напитках

решенные упражнения
Вопрос 1 - (Enem) Сок, извлеченный из краснокочанной капусты, можно использовать как индикатор кислотного характера (pH от 0 до 7) или основного (pH от 7 до 14) различных растворов. При смешивании небольшого количества капустного сока и раствора смесь начинает приобретать разные цвета в зависимости от ее кислотной или щелочной природы в соответствии с приведенной ниже шкалой.
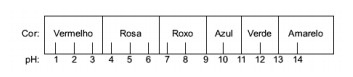
Некоторые решения были протестированы с этим индикатором, и были получены следующие результаты:
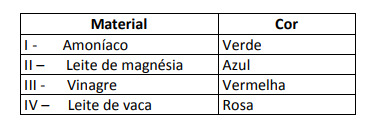
Согласно этим результатам, решения I, II, III и IV соответственно имеют следующий характер:
А) кислотный / основной / основной / кислый.
Б) кислотный / основной / кислотный / основной.
В) основной / кислотный / основной / кислый.
Г) кислотный / кислотный / основной / основной.
E) Основное / Основное / Кислотное / Кислотное.
разрешение
Альтернатива E. Чтобы определить, имеет ли вещество кислотный, щелочной или даже нейтральный характер, проводится анализ цветов, полученных в ходе испытания, по отношению к данным данной шкалы. Зная, что растворы с pH = 7 являются нейтральными, pH> 7 - щелочными, а с pH <7 - кислыми, мы приходим к вывод, что аммиак и молоко магнезии являются основными веществами, а уксус и коровье молоко - кислоты.
Вопрос 2 - (PUC-Camp) Что касается веществ, называемых кислотами, студент отметил следующие характеристики:
I - обладают агрессивной способностью;
II - способны нейтрализовать базы;
III - состоят из двух химических элементов;
IV - образуют водные растворы, проводящие электрический ток.
Он делал ошибки ТОЛЬКО в
А) I и II
Б) I и III
В) I и IV
Г) II и III
E) III и IV
разрешение
Альтернатива Б. Не все кислоты вызывают коррозию, только самые сильные, а кислоты могут состоять из двух или более атомов.
Лайса Бернардес
Учитель химии
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
ARAúJO, Лайса Бернардес Маркес де. «Кислоты»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/acidos.htm. Доступ 27 июня 2021 г.