Ферменты биологические катализаторы, ответственные за увеличение скорости данной химической реакции. Ферменты обычно белки, но есть некоторые рибонуклеиновые кислоты которые действуют как ферменты, называемые рибозимами.
Чтобы ускорить реакцию, ферменты должны связываться с реагентами, которые известны как субстраты. Долгое время считалось, что эта связь происходит очень жестко, по схеме, известной как замок с ключом. в данный момент, Тем не мение, принята модель, известная как индуцированная подгонка., что предполагает, что в форме фермента происходят небольшие изменения по мере того, как субстрат входит в активный центр.
Читайте тоже: Что такое метаболизм?
Что такое ферменты?
Ферменты - это биомолекулы, которые действуют как катализаторы, то есть они вещества, способные ускорять скорость химические реакции которые происходят у живых существ, но не потребляются во время этих реакций. Без действия ферментов некоторые реакции были бы очень медленными, что нанесло бы вред метаболизму. Ферменты избирательно ускоряют реакции и поэтому являются очень специфическими катализаторами.
Ферменты могут ускорить реакцию за счет уменьшения энергии активации, то есть они уменьшают количество энергии, которое необходимо добавить для начала реакции.
[публикация_омния]
Каждый фермент - это белок?
Хотя их часто определяют как биологические катализаторы белковой природы, не каждый фермент является белком. Есть некоторые РНК, которые действуют как ферменты, называемые рибозимами. Однако большинство ферментов представляют собой белки, поэтому они образуются аминокислоты. Аминокислотный состав этих биомолекул определяет их трехмерную структуру.
Читайте тоже: Как работают каталитические вещества?
Фермент-субстратный комплекс
Его называют реактивным субстратом, на который действует фермент. Когда фермент связывается со своим субстратом, комплекс образует фермент-субстрат. Это связывание происходит в определенной области, называемой активным сайтом.
Когда мы говорим о ферментах на основе белков, активный сайт соответствует всего нескольким аминокислотам, а остальная часть молекулы отвечает за определение конфигурации активного сайта. Форма активного центра, а также форма субстрата связаны со специфичностью фермента, поскольку они должны дополнять друг друга.
Модель с замком с ключом
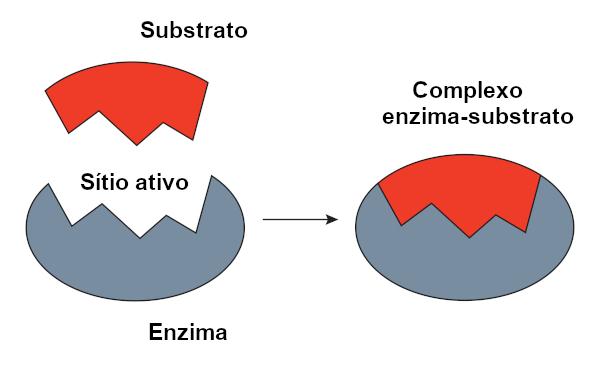
O модель с замком, предложенный Эмилем Фишером, широко используется для объяснения взаимодействия между ферментом и субстратом. Согласно этой модели, существует жесткая комплементарность между ферментом и субстратом, как ключ и замок. Активный центр фермента должен иметь форму, дополняющую субстрат, которая идеально подходит. Следовательно, другие молекулы не будут иметь доступа к этому сайту, что гарантирует специфичность фермента. Подобно тому, как ключ открывает только замок, фермент может связываться только с субстратом. Однако сегодня мы знаем, что это модель не правильная, поскольку ферменты не являются жесткими структурами, как считалось ранее.
Модель искусственной подгонки
В настоящее время наиболее распространенная модель для объяснения связи между ферментом и его субстратом один из щелчок индуцированный, первоначально предложенный Koshland et al. Активный сайт и подложка не работают жестко, как ключ и замок. Исследования показывают, что когда субстрат входит в активный центр, фермент претерпевает небольшую модификацию, которая способствует согласованию между активным центром и субстратом. Чтобы лучше понять эту модель, мы можем представить взаимодействие фермента и субстрата как рукопожатие, которое становится более прочным после первого контакта.
Кофакторы
Большинству ферментов необходимы вспомогательные молекулы для каталитического действия, называемые кофакторами. Кофакторы могут быть постоянно прикреплены к ферменту или могут быть слабо и обратимо прикреплены к субстрату. Они также может быть неорганическим или органическим. Когда кофакторы представляют собой органические молекулы, их называют коферменты.
Некоторый витамины действуют как коферменты, например, рибофлавин, также известный как витамин В2. В качестве примеров неорганических кофакторов можно упомянуть железо и цинк в их ионной форме.
Читайте тоже: Витамины B-комплекса - группа витаминов, которые обычно действуют как коферменты.
Классификация ферментов
Ферменты можно разделить на шесть групп, используя в качестве критерия тип реакции, которую они катализируют.
Оксидоредуктазы: ферменты, связанные с реакциями оксирснижение.
Трансферазы: катализируют перенос групп от одного соединения к другому.
Гидролазы: катализировать реакции гидролиза.
Лиасы: действуют, добавляя группы к двойным связям или удаляя группы, образующие двойную связь.
Изомеразы: катализировать реакции изомеризации.
Ссылки: ферменты, вызывающие деградацию молекулы АТФ, используя энергию, выделяемую в этой реакции, для образования новых соединений.
Факторы, регулирующие активность ферментов
На активность фермента влияют факторы, главными из которых являются температура и pH. Температура обычно играет положительную роль в химических реакциях, увеличивая скорость ферментативной реакции. Однако когда температура увеличивается выше оптимальных условий, скорость реакции значительно падает. Это связано с тем, что наблюдается денатурация белков. Оптимальная температура большинства ферментов человека составляет от 35 до 40 ° C. Помимо температуры, pH он также влияет на ферментативную активность, и это тоже оптимальное значение. Для большинства ферментов оптимальное значение pH находится в диапазоне от 6 до 8.
Автор: Ванесса Сардинья душ Сантуш
Учитель биологии
