В тексте "Магматический электролиз», Было объяснено, что этот процесс происходит при пропускании электрического тока в расплавленном веществе (в жидком состоянии) без присутствия вода, и, таким образом, катион получает электроны, а анион отдает электроны, так что оба имеют электрический заряд, равный нулю, и энергию накоплено.
Чтобы лучше понять, как происходит магматический электролиз, давайте рассмотрим один из наиболее важных примеров этого типа процесса - электролиз хлорида натрия или поваренной соли (NaCl).
Хлорид натрия образуется в природе в результате передачи электрона от натрия (Na) к хлору (Cl) в соответствии с реакцией, приведенной ниже:
2Na (с) + 1Cl2(г) → 2NaCl (т)

Этот процесс является спонтанным, но обратный процесс этой реакции не является спонтанным, то есть образование газообразного хлора (Cl2(g) - рисунок ниже) и металлический натрий (Na (s)) в природе не встречается. Если мы хотим, чтобы это произошло, нам придется начать процесс.
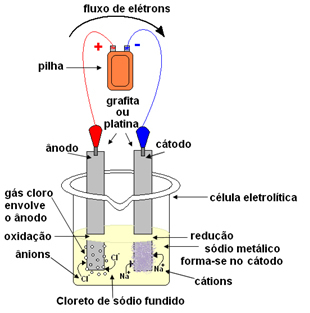
Это можно сделать с помощью магматического электролиза. Соль нагревают до температуры выше 800,4 ° C, что является ее температурой плавления; и таким образом он сливается, переходя из твердого состояния в жидкое. В этом физическом состоянии ваши ионы Na
+ и Cl- свободны.Затем расплав соли помещают в контейнер, электролитический сосуд, и два инертных платиновых или графитовых электрода погружают в хлорид натрия. Эти электроды подключены к источнику, генерирующему постоянный электрический ток, например к батарее или элементу.
При прохождении электрического тока происходит следующее:
- Отрицательный полюс батареи или элемента подает электроны к одному из электродов, который становится катодом;
- Катод: принимает электроны из ячейки и становится отрицательным полюсом, притягивая катионы Na+, потому что притягиваются противоположные заряды. Эти ионы получают электроны от электрода (катода), и происходит их восстановление с образованием металлического натрия:
Снижение:В+(ℓ) + и- → В(s)
Металлический натрий откладывается поверх электрода и отправляется в резервуар.
- Анод: становится положительно заряженным, привлекая анионы Cl- (поэтому он называется анодом). Эти ионы теряют свои электроны, когда вступают в контакт с анодом, и, следовательно, они подвергаются окислению, образуя атомы хлора, которые немедленно соединяются по два с образованием газообразного хлора:
Окисление:2Cl-(ℓ) → 2 и- + 1Cl2(грамм)
Этот газ пузырится вокруг анода и собирается стеклянной трубкой, адаптированной к системе.
Таким образом, общая реакция, возникающая в этом случае, определяется следующим образом:
Катод: 2Na+(ℓ) + 2e- → 2Na(s)
Анод: 2Cl-(ℓ) → 2 и- + 1Cl2(грамм) ____________
Глобальная реакция: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(грамм)
Еще один важный аспект, о котором следует знать, который был выделен в конце упомянутого текста («Магматический электролиз»), - это то, что для электролиза происходит, элемент или батарея, используемые для генерации электрического тока, должны иметь ddp (разность потенциалов), равную или превышающую разность потенциалов реакция.
Давайте посмотрим на это в случае электролиза хлорида натрия, который мы рассматриваем. Чтобы определить разность потенциалов этой реакции, достаточно уменьшить стандартный восстановительный потенциал катода на анодный. Это объясняется в тексте. Возможная разница батареи .
Через таблицу стандартных восстановительных потенциалов (E0красный), мы знаем, что:
В+(ℓ) + и- → В(s) А ТАКЖЕ0красный = -2,71
2Cl-(ℓ) → 2 и- + 1Cl2(g) И0красный = +1,36
Теперь просто уменьшите эти значения, чтобы узнать разность потенциалов глобальной реакции:
∆И0 = И0красный (катод) - А ТАКЖЕ0красный (анод)
∆И0 = -2,71 – (+ 1,36)
∆И0 = - 4,07 В
Следовательно, это означает, что элемент или батарея, которые будут использоваться, должны иметь напряжение, равное или превышающее 4,07 В, чтобы проводить электролиз хлорида натрия с пламенем.
Отрицательное значение указывает только на то, что это не спонтанный процесс.. В случае батарей, что является спонтанным процессом, значение электродвижущей силы (∆E0) всегда дает позитив.
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm
