THE угловая геометрия один из нескольких типов молекулярная геометрия, который по-прежнему может быть линейным, пирамидальным, плоским тригональным, четырехгранный, так далее. Угловую геометрию можно найти только в молекулах, которые обладают следующими характеристиками:
Триатомика, то есть у них есть только три атома;
В центральном атоме должно быть не менее трех электронных облаков.
Примечание: электронное облако - это все Ковалентная связь (одинарные, двойные, тройные или координаты) между атомами и электронными парами валентный слой кто не участвует в звонке.
См. Несколько примеров молекул с угловой геометрией:
1-й пример: вода (H2O)

обычная структура воды
В составе воды мы имеем:
Три атома: два атома водорода и один кислород;
Кислород является центральным атомом, потому что он образует большее количество связей (две, поскольку он принадлежит к семейству VIA);
Две одинарные связи между кислородом и водородом. Это потому, что каждый водород может образовывать только одну связь, а кислород - две связи;
Четыре несвязывающих электрона в кислороде, поскольку он имеет шесть электронов в валентной оболочке и использует только два в связях.
Следовательно, как и в молекуле воды, в центральном атоме есть три атома и четыре электронных облака (две одинарные связи и две несвязывающие пары электронов), геометрия угловатая.
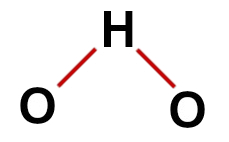
Правильная структурная формула воды
Примечание: Всякий раз, когда молекула представляет эти узоры, угол между атомами составляет примерно 109º 28'.
2-й пример: Диоксид серы (SO2)

Обычная структура диоксида серы
В составе диоксида серы мы имеем:
Три атома: два атома кислорода и один атом серы;
Сера является центральным атомом, так как это самый маленький элемент в молекуле, поскольку все элементы должны образовывать одинаковое количество связей (две);
Двойная связь между серой и одним из атомов кислорода. Это потому, что оба требуют двух соединений;
Один координационная или дательная ковалентная связь, потому что сера была стабильной после спаривания с другим кислородом, но атом кислорода все еще нуждается в двух электронах;
Четыре несвязывающих электрона в кислороде. Это потому, что кислород имеет шесть электронов в валентной оболочке и использует только два в связях.
Таким образом, как и в молекуле диоксида серы, в центральном атоме есть три атома и четыре электронных облака (две одинарные связи и две пары несвязывающих электронов), геометрия угловатая.
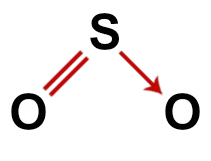
Правильная структурная формула диоксида серы
Примечание: Когда молекула имеет эти узоры, угол между атомами составляет примерно 120 °.О.
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-geometria-angular.htm
