у нас есть смешивание растворов с различными растворенными веществами без химической реакции когда две или более смеси, содержащие вещества с одним и тем же ионом, являются общими (один и тот же катион или один и тот же анион). Как в примере ниже:
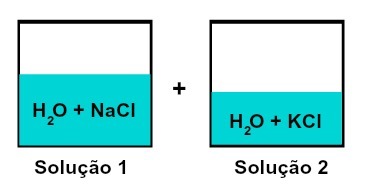
Смесь растворов с разными растворенными веществами
Раствор 1 - это вода и хлорид натрия (NaCl), а раствор 2 - вода и хлорид калия (KCl). При смешивании мы получаем смешивание различных растворов без химической реакции, поскольку обе используемые соли содержат хлорид-анион (Cl-).
1- Характеристики смесей различных растворенных веществ без химической реакции
При приготовлении смеси растворов с различными растворенными веществами без химической реакции всегда проверяются следующие характеристики:
Масса каждого из растворенных веществ не изменяется (если в растворе 1 у нас есть 10 г растворенного вещества, а в 2, 30 г, например, после смешивания у нас будет одинаковая масса каждого растворенного вещества),
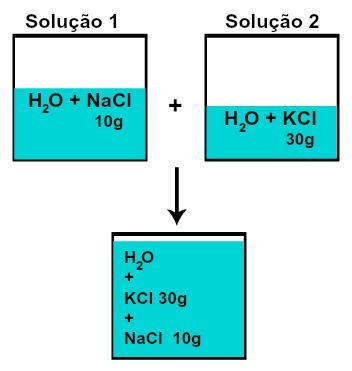
Масса каждого из растворенных веществ после смешивания растворов без химической реакции
В количество материи (n) каждого из растворенных веществ не изменяется (если в растворе 1 имеется 5 моль растворенного вещества, а в 2,4 моль, например, после смешивания у нас будет такое же количество вещества каждого из них),
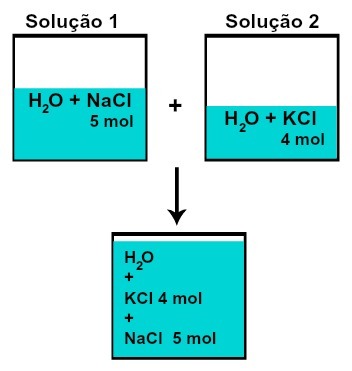
Количество молей каждого из растворенных веществ после смешивания растворов без химической реакции
Объем конечного раствора, ВF, является результатом суммы объемов каждого из смешанных растворов (если в растворе 1 у нас 200 мл, а в растворе 2 - 300 мл, например, после смешивания у нас будет объем 500 мл),
VF = V1 + V2
2- Формулы, используемые в расчетах смешивания растворов различных растворенных веществ без химической реакции.
Поскольку в смесях этого типа количество растворителя увеличивается только по отношению к каждому из растворенных веществ, мы должны рассчитать конечную концентрацию каждого из растворенных веществ, используя следующие выражения:
а) К общая концентрация (Ç)
Для раствора 1: умножение концентрации раствора 1 на его объем равно конечной концентрации, умноженной на его объем.
Ç1.V1 = CF.VF
Для раствора 2: умножение концентрации раствора 2 на его объем равно конечной концентрации, умноженной на его объем.
Ç2.V2 = CF.VF
б) К концентрация в количестве вещества или молярности (М)
Для решения 1:
M1.V1 = MF.VF
Для решения 2:
M2.V2 = MF.VF
c) Концентрация количества вещества каждого иона, присутствующего в растворе.
Если нам нужно определить концентрацию одного или всех ионов, присутствующих в конечном растворе, мы должны:
1º: Помните, что концентрация ионов дается путем умножения концентрации (M) растворенного вещества, из которого он происходит, на его индекс в формуле вещества. Итак, для иона Y в веществе 1 XY3, концентрация будет:
[Y]1 = 3. M
Что касается solute2, ZY, концентрация Y будет определяться следующим образом:
[Y]2 = 1. M
2º: Если у нас есть более одного растворенного вещества, которое выделяет один и тот же ион, например, раствор XY3 и ZY, которые имеют один и тот же ион Y, концентрация этого иона в конечном растворе определяется суммой его концентраций для каждого растворенного вещества:
[Y]F = [Y]1 + [Y]2
3- Примеры расчетов, включающих смешивание растворов различных растворенных веществ без химической реакции
Пример 1: (PUC SP) В химическом стакане смешивали 200 мл водного раствора хлорида кальция (CaCl).2) концентрацией 0,5 моль. L–1 и 300 мл 0,8 моль раствора. L–1 хлорида натрия (NaCl). Полученный раствор имеет концентрацию хлорид-аниона примерно:
а) 0,34 мол. L–1
б) 0,65 мол. L–1
в) 0,68 мол. L–1
г) 0,88 мол. L–1
д) 1,3 мол. L–1
Данные, полученные в ходе учений, были следующими:
Решение 1:
Объем (В1): 200 мл
Молярная концентрация (M1): 0,5 мол. L–1
Решение 2:
Объем (В2): 300 мл
Молярная концентрация (M2): 0,8 мол. L–1
Для определения концентрации хлорид-анионов (Cl-), мы должны выполнить следующие шаги:
Шаг 1: рассчитать объем финального раствора
VF = V1 + V2
VF = 200 + 300
VF = 500 мл
Шаг 2: Рассчитайте молярную концентрацию конечного раствора по отношению к растворенному веществу CaCl.2, используя приведенное ниже выражение:
M1.V1 = MF.VF
0,5 200 = МF.500
100 = МF.500
100 = MF
500
MF = 0,2 моль. L–1
Шаг 3: Рассчитайте молярную концентрацию хлорида [Cl-]1в конечном растворе из растворенного вещества CaCl2, используя приведенное ниже выражение:
ПРИМЕЧАНИЕ: В формуле мы имеем умножение молярности на 2, потому что у нас есть индекс 2 в Cl, в формуле растворенного вещества CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 моль. L–1
Шаг 4: Рассчитайте молярную концентрацию конечного раствора по отношению к растворенному веществу NaCl, используя приведенное ниже выражение:
M2.V2 = MF.VF
0,8,300 = МF.500
240 = МF.500
240 = MF
500
MF = 0,48 моль. L–1
Шаг 5: Рассчитайте молярную концентрацию хлорида, [Cl-]2в конечном растворе из растворенного вещества NaCl, используя следующее выражение:
ПРИМЕЧАНИЕ: В формуле мы имеем умножение молярности на 1, потому что у нас есть индекс 1 в Cl, в формуле для растворенного NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 моль. L–1
Шаг 6: Рассчитайте общее количество хлорид-ионов в конечном растворе.
Для этого просто добавьте молярные концентрации хлоридов для каждого из растворенных веществ на шагах 3 и 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 моль. L–1
Пример 2: К раствору 500 мл 6 моль / л КОН было добавлено 300 мл раствора К.2ТОЛЬКО3 3 моль / л. Какова концентрация каждого из растворенных веществ в полученной смеси
а) 3,75 и 3,0 моль / л
б) 3,75 и 1,215 моль / л
в) 4,5 и 1,125 моль / л
г) 3,75 и 1,125 моль / л
д) 4,5 и 1,215 моль / л
Данные, полученные в ходе учений, были следующими:
Решение 1:
Объем (В1): 500 мл
Молярная концентрация (M1): 6 мол. L–1
Решение 2:
Объем (В2): 300 мл
Молярная концентрация (M2): 3 мол. L–1
Для определения концентрации хлорид-анионов (Cl-), мы должны выполнить следующие шаги:
Шаг 1: рассчитать объем финального раствора
VF = V1 + V2
VF = 500 + 300
VF = 800 мл
Шаг 2: Рассчитайте молярную концентрацию конечного раствора по отношению к растворенному веществу КОН, используя приведенное ниже выражение:
M1.V1 = MF.VF
6500 = МF.800
3000 = МF.800
3000 = MF
800
MF = 3,75 моль. L–1
Шаг 3: Рассчитайте молярную концентрацию конечного раствора по отношению к растворенному веществу K2ТОЛЬКО3, используя приведенное ниже выражение:
M2.V2 = MF.VF
3300 = МF.800
900 = МF.800
900 = MF
800
MF = 1,125 моль. L–1
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm


