THE электроотрицательность это тенденция атома притягивать электроны к себе, когда он связан с другим химическим элементом. через ковалентную связь, то есть в которой электроны разделены, рассматривая эту молекулу как изолированные.
Давайте рассмотрим два примера, чтобы лучше понять представленную концепцию:
1-й пример: молекула газообразного водорода: H2 → H - H
Когда два атома водорода объединяются, силы притяжения между ядрами каждого из них возникают одновременно. один из этих атомов электроном другого атома и силы отталкивания между электронами и ядрами двух атомы. Когда эти силы достигают равновесия, два электрона находятся в области электросфер, которая находится где-то между ними. атомы молекулы, в которых оба взаимодействуют с двумя электронами, становясь стабильными, то есть два атома разделяют пару электроны.
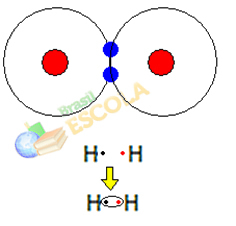
Это ковалентная связь, образующая молекулу. Но поскольку два атома этой молекулы абсолютно одинаковы, то и то, как они притягивают электроны друг к другу, одинаково. Итак, мы говорим, что нет разницы в электроотрицательности или что она это аполярно.
2-й пример: молекула хлористого водорода: HCℓ
В этом случае разделение электронной пары осуществляется между разными элементами, поскольку в этой связи атом хлора притягивает электроны с большей интенсивностью, чем водород. Поэтому мы говорим, что хлор более электроотрицателен, чем водород.
Как показано на рисунке ниже, из-за разницы в электроотрицательности электрический диполь (μ), которые представляют собой два электрических монополя, электроны которых больше притягиваются к хлору. Таким образом, связь H ─ Cℓ будет иметь частичный отрицательный заряд на хлоре (δ-) и частичный положительный заряд на водороде (δ+). Итак, это молекула с разницей электроотрицательности и является полярный:
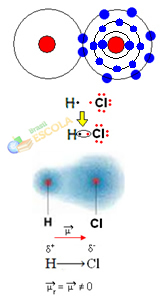
Это показывает нам, что электроотрицательность является относительной, а не абсолютной величиной, поскольку она определяется путем сравнения сил, действующих между атомами в ковалентной связи.
Есть несколько способов рассчитать электроотрицательность, но наиболее распространенным является шкала электроотрицательности, предложенная Полингом. Допустим, у нас есть общая молекула А ─ Б. Полинг предположил, что энергия связи этой молекулы, обозначенная буквой D, будет выражаться суммой среднего арифметического энергий связи. (D) молекул газа этих двух атомов, то есть A-A и B-B, с квадратом разности электроотрицательностей каждого атома этой молекулы (ИксTHE и хB):
D(А-В) = [D(А-А) + D(B-B)] + k (xTHE - ИксB)2
Константа k в приведенной выше формуле равна 96,5 кДж. моль-1. Полинг присвоил произвольное значение электроотрицательности водорода, равное 2,1, и таким образом можно было обнаружить значение электроотрицательности других элементов по отношению к он.
На основе этого метода значения электроотрицательности Полинга были даны для элементов Периодической таблицы, за исключением благородных газов.

Обратите внимание, что эти значения являются периодическим свойством, поскольку они периодически меняются в зависимости от атомных номеров элементов. См., Например, что наиболее электроотрицательные элементы находятся в правом верхнем углу таблицы, то есть фтор (4,0) и кислород (3,5), а наименее электроотрицательными являются те, которые находятся в нижнем левом углу, это франций (0,8) и цезий. (0,8).
Исходя из этого, был даже создан ряд электроотрицательностей самых электроотрицательных элементов, которые имеют тенденцию работать больше всего:
F> O> N> Cℓ> Br> I> S> C> P> H
Смотрите значения электроотрицательности:
4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Существует своего рода «трюк» для украшения этого ряда электроотрицательности, который дается нижеследующим предложением, в котором начало каждого слова соответствует символу рассматриваемых элементов:
“FПривет Оне иметь NО Clубэ brя получил яsОй Çумирающий пдля ЧАСбольница "
Итак, мы можем сказать, что Электроотрицательность - это периодическое свойство, которое увеличивается слева направо и снизу вверх в Периодической таблице.

Это из-за размера атомного радиуса. Чем больше радиус атома, тем дальше общие электроны находятся от его ядра и, следовательно, тем слабее притяжение между ними. Верно и обратное: чем меньше радиус атома, тем ближе электроны к ядру и тем сильнее притяжение между ними. Таким образом, можно сделать следующие выводы:
Электроотрицательность увеличивается с уменьшением атомного радиуса.
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/eletronegatividade.htm
