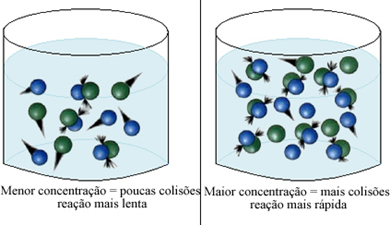
Отметим, что всякий раз, когда мы увеличиваем концентрацию одного или всех реагентов, участвующих в химической реакции, увеличивается скорость ее развития, то есть скорость реакции.
Обратное тоже верно. Например, в настоящее время рекомендуется использовать спиртовой гель вместо обычного спирта, поскольку он снижает риск возгорания и, таким образом, позволяет избежать несчастных случаев. Обычный жидкий спирт на самом деле представляет собой смесь спирта и воды, причем гелевый спирт содержит меньшее количество спирта. Следовательно, когда концентрация одного из реагентов горения снижается, в случае спирта реакция протекает медленнее. С другой стороны, чем чище спирт, тем быстрее реакция горения.

Как сказано в тексте Условия возникновения химических реакций., одним из условий протекания реакции является эффективное столкновение между частицами. Таким образом, увеличение концентрации реагентов позволяет удерживать большее количество частиц или молекул в одном и том же пространстве. Это увеличивает количество столкновений между ними, а также увеличивает вероятность возникновения эффективных столкновений, которые приведут к возникновению реакции. В результате реакция происходит быстрее.
Чтобы убедиться в этом, подумайте о следующем примере: когда у нас есть горящий тлеющий уголь, и мы хотим, чтобы это горение происходило быстрее, мы дуть или раздуваем уголь? Почему это работает?
Что ж, одним из реагентов в этой реакции горения является кислород воздуха. Когда мы встряхиваем, воздушный поток удаляет золу, образующуюся во время горения, и это облегчает контакт кислорода с тлеющим углем. Таким образом, мы увеличиваем контакт между реагентами и ускоряем реакцию горения.
Вкратце:

При работе с газами одним из способов увеличения концентрации реагентов является понизить давление. Когда мы это делаем, мы уменьшаем объем и, как следствие, повышаем концентрацию реагентов.

Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm