В повседневной жизни и в лабораториях есть реакции и трансформации, которые являются спонтанными, а другие - не спонтанными. Например, любое сгорание является спонтанной реакцией, потому что после начала оно будет продолжаться до тех пор, пока не будет израсходовано все топливо или пока не уйдет весь кислород.
С другой стороны, электролиз - это не самопроизвольный процесс, в котором электрическая энергия преобразуется в химическую энергию. Примером может служить электролиз хлорида натрия (NaCl). Когда электрический ток пропускается через этот расплав соли, происходят окислительно-восстановительные реакции и образование металлического натрия (Na(s)) и газообразный хлор (Cl2 (г)). Если мы перестанем пропускать электрический ток, реакция не будет продолжаться сама по себе, что показывает, что она не является спонтанной.
Спонтанность реакции можно измерить с помощью Уравнение Гиббса-Гельмгольца, нижеприведенный:

На что:
∆G = изменение свободной энергии;
∆H = изменение энтальпии;
T = температура в Кельвинах (всегда положительная);
∆S = изменение энтропии.
Это уравнение получило свое название потому, что оно было предложено американским физиком Дж. Уилларда Гиббса (1839–1903) и немецкого физика Германа Гельмгольца (1821–1894).
Чтобы лучше понять, как это уравнение помогает нам определить спонтанность реакции, давайте кратко рассмотрим каждую из задействованных в нем концепций:
- ∆H (изменение энтальпии): Энтальпия (H) - это содержание энергии в веществе. Пока ни о каком способе его определения не известно. На практике достигается измерение изменения энтальпии (∆H) процесса с помощью калориметров. Этот вариант представляет собой количество энергия, которая была высвобождена или поглощена в процессе.
- ∆S (изменение энтропии):Энтропия (S) - это термодинамическая величина, которая измеряет степень беспорядка в системе.
Например, при таянии льда молекулы переходят из твердого состояния в жидкое, где наблюдается большая дезорганизация. Это означает, что в этом процессе энтропия увеличивалась (∆S> 0).
При производстве аммиака (NH3) 1 моль газообразного азота реагирует с 3 молями газообразного водорода (то есть с 4 молями молекул в реагентах), образуя 2 моля аммиака:
N2 (г) +3 H2 (г) → 2 NH3 (г)
Поскольку количество молекул в газовой фазе в этом процессе уменьшается, дезорганизация уменьшалась, а это означает, что энтропия также уменьшалась (∆S <0).
- ∆G (свободная энергия): Бесплатная энергия или Свободная энергия Гиббса (потому что он был предложен только этим ученым в 1878 г.) полезная энергия системы, которая используется для работы.
Система имеет глобальную энергию, но только часть этой энергии будет использоваться для выполнения работы, это называется свободной энергией Гиббса, символизируемой грамм.
По словам Гиббса, процесс считается самопроизвольным, если он выполняет работу, то есть если G уменьшается. В этом случае конечное состояние преобразования будет более устойчивым, чем начальное, когда ∆G <0.
Исходя из этого, можно сделать следующие выводы:

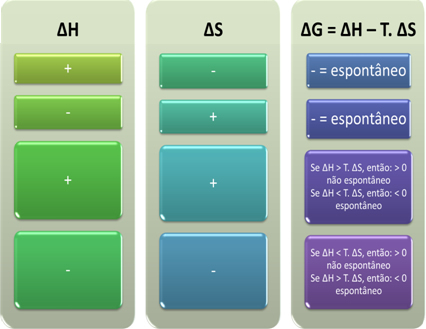
Мы также можем увидеть, будет ли процесс спонтанным, посмотрев на алгебраический знак ∆H и ∆S в уравнении Гиббса-Гельмгольца:
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm


