Окислительно-восстановительные реакции, протекающие в присутствии перекиси водорода (водный раствор перекиси водорода - H2О2 (водн.)) представляют собой особый случай, который необходимо анализировать отдельно, главным образом в отношении его баланса. Это связано с тем, что атомы кислорода в перекиси водорода, у которых Nox равен -1, могут либо окисляться, либо восстанавливаться.
Например, давайте рассмотрим два случая, в которых он сначала ведет себя как окислитель (восстанавливающий), а затем как восстановитель (окисляющий):
- окислитель: всякий раз, когда перекись водорода восстанавливается, действуя как окислитель, в качестве продукта образуется вода.
Если добавить раствор перекиси водорода в раствор, содержащий иодид-ионы (I-) в кислой среде получим:
ЧАС2О2 (водн.) + Я-(здесь) + H+(здесь) → H2О(1) + Я2 (с)
Смотрите, что образуются вода и йод. Но чтобы проверить, действительно ли перекись водорода действует как окислитель и восстанавливает, наблюдайте за определением степеней окисления (NOx): *

Кислородный Nox перекиси водорода снизился с -1 до -2, учитывая, что он получил 1 электрон. Однако, поскольку у нас есть два атома кислорода в каждой молекуле перекиси водорода (H2О2) вариация Nox будет равна 2.
Итак, как показано в тексте «Балансировка окислительно-восстановительного потенциала”, Необходимый шаг для уравновешивания реакций с помощью окислительно-восстановительного метода состоит в том, чтобы инвертировать значения вариаций NOx с помощью коэффициентов, в данном случае следующим образом:
* H2О2 = 2 (∆Nox) = 2 → 2 будет коэффициентом I-;
* Я-= ∆Nox = 1 → 1 будет коэффициентом при H2О2.
Таким образом, мы имеем:
1 час2О2 (водн.) + 2 я-(здесь) + H+(здесь) → H2О(1) + Я2 (с)
Попадание в другие коэффициенты путем балансировки по испытаниям:
- Поскольку в 1-м члене два атома кислорода, коэффициент воды во 2-м члене должен быть равен 2. А поскольку в 1-м члене также есть два иодид-иона, йодный коэффициент во 2-м члене будет равен 1. Не забывайте, что мы должны умножить индекс на коэффициент, чтобы найти правильное количество атомов и ионов в каждом члене:
1 час2О2 (водн.) + 2 я-(здесь) + H+(здесь) → 2 H2О(1) + 1 я2 (с)
- Теперь осталось только уравновесить катион водорода 1-го члена, и его коэффициент должен быть равен 2, потому что во 2-м члене у него 4 атома водорода, а в 1-м члене уже два:
1 час2О2 (водн.) + 2 я-(здесь) +2 H+(здесь) → 2 H2О(1) + 1 я2 (с)
- Восстановитель: всякий раз, когда перекись водорода окисляется, действуя как восстановитель, она генерирует кислород (O2) как продукт.
Примером восстановления перекиси водорода является контакт с перманганатом калия (KMnO4). Это вещество имеет очень характерный фиолетовый цвет, но при контакте с перекисью водорода становится бесцветным. Это связано с тем, что весь марганец, присутствующий в ионе MnO4- раствора перманганата уменьшается, что приводит к образованию иона Mn2+, как показано ниже:
+1 -1 +7 -2 +1 0 +2 +1 -2
ЧАС2О2 + MnO4-+ H+ → The2 + Mn2++ H2О
Вычисляя Nox, мы видим, что кислород в перекиси водорода действительно окисляется и вызывает восстановление марганца:
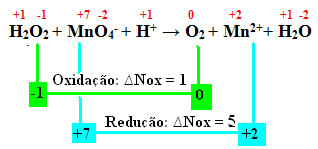
Как и в предыдущем примере, ∆Nox перекиси водорода будет равно 2, поскольку есть два атома кислорода, и каждый из них теряет электрон. Таким образом, мы имеем:
* O2 = 2 (∆Nox) = 2 → 2 будет коэффициентом MnO4-;
* MnO4- = ∆Nox = 5 → 5 будет коэффициентом при O2.
И как и все2 происходит из перекиси водорода, два вещества имеют одинаковый коэффициент:
5 ЧАС2О2 + 2MnO4-+ H+ → 5 О2 + Mn2++ H2О
Уравновешивая пробным методом, имеем:
5 часов2О2 + 2 MnO4-+ 6 часов+ → 5 O2 + 2 млн2++ 8 часов2О
* По любым вопросам о том, как рассчитать степень окисления (Nox) атомов и ионов в реакции, прочтите текст «Определение числа окисления (Nox)».
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-envolvendo-agua-oxigenada.htm
