Среди сложностей атомных исследований - определение размера атома или, лучше, его размера. атомный луч. Это периодическое свойство описывает расстояние от ядра до внешнего электрона его электронных уровней. Для его определения выполняется среднее арифметическое расстояния между ядрами двух атомов, образующих, например, простое вещество.
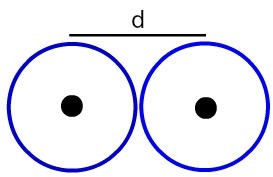
Представление расстояния между двумя атомными ядрами
Определим атомный радиус (РА) атомов, представленных на изображении. Для этого просто разделите расстояние между жилами на 2:
RA = d
2
О исследование атомных лучей важен, потому что способствует пониманию некоторых физических явлений (плотность, точка плавление, температура кипения и энергия ионизации) и химические вещества (химические связи), которые возникают с атомы.
Анализируя таблицу Менделеева, мы можем оценить, является ли атом больше или меньше по сравнению с другим, и, таким образом, определить, более или менее просто удалить один или несколько электронов с их орбиталей. В оценка и определение атомного радиуса в периодической таблице выполняется по двум основным критериям:
а) Количество уровней энергии (семейства или группы / вертикальные столбцы)
Мы знаем, что атомы могут иметь до семи уровней энергии (K, L, M, N, O, P, Q) и что каждый химический элемент расположен в семьях или группах (вертикальные столбцы) и периодах (столбцы горизонтальный). Точки указывают количество уровней атома элемента, а семейство указывает наиболее энергетический подуровень атома. В группе или семье химические элементы различаются по количеству уровней энергии. См. Таблицу ниже:

Чем больше у атома уровней энергии, тем больше его атомный радиус. Анализируя приведенную выше таблицу, можно увидеть, что у франция самый большой атом, потому что он имеет семь уровней. Атом калия, с другой стороны, имеет меньший радиус, так как он имеет четыре энергетических уровня. Ниже приводится сравнительное представление атома франция и атома калия:
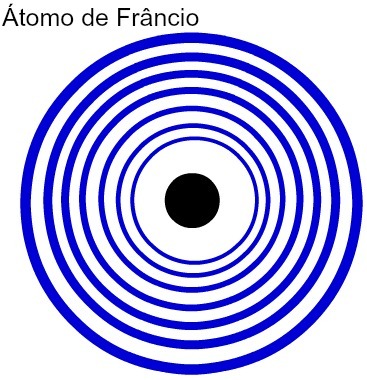
Представление семи энергетических уровней атома франция

Представление четырех энергетических уровней атома калия
На следующей диаграмме показано, как увеличение атомного радиуса происходит в том же семействе или группе (вертикальные столбцы) периодической таблицы. Чем больше уровней, тем больше радиус, т. Е. в периодической таблице атомный радиус растет сверху вниз:
Представление того, как атомный радиус увеличивается в семействе периодической таблицы
б) Атомный номер (Z или количество протонов) за тот же период (горизонтальный столбец)
Когда химические элементы принадлежат к одному периоду, их атомы имеют одинаковое количество уровней энергии, но количество протонов внутри их ядер разное. Ниже приводится последовательность элементов, принадлежащих четвертому периоду таблицы Менделеева:
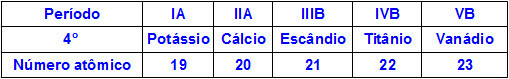
Все атомы элементов, представленных в таблице выше, имеют четыре энергетических уровня, но каждый из них имеет разное количество протонов в своих ядрах. Поскольку протоны внутри ядра оказывают притягивающую силу на электроны, находящиеся на энергетических уровнях, чем больше протонов в ядре, тем сильнее их притяжение к электронам.. Результатом является приближение уровней к ядру, уменьшение размера атома.
↑Z = ↓ Атомный радиус
↓Z = ↑ Атомный радиус
Таким образом, мы можем утверждать, что атомный радиус элемента калия больше, чем у ванадия из-за меньшего числа протонов.
На следующей диаграмме показано, как увеличение атомного радиуса происходит за тот же период (горизонтальная линия). Чем меньше атомный номер, тем больше радиус, то есть атомный радиус в таблице растет справа налево.
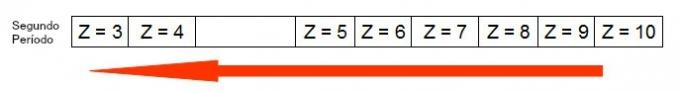
Представление того, как атомный радиус увеличивается в период периодической таблицы
Автор: Диого Лопес Диа


