Ионная связь происходит между ионами, как следует из названия. Поскольку они имеют противоположные заряды, катионы (элемент с положительным зарядом) и анионы (элемент с отрицательным зарядом) электростатически притягиваются друг к другу, образуя связь. Однако твердое ионное вещество состоит из агломерата катионов и анионов, организованных в виде четко определенных геометрических форм, называемых решетками или кристаллическими решетками.
Например, соль (хлорид натрия) образуется в результате окончательного переноса электрона от натрия к хлору, в результате чего образуется катион натрия (Na+) и хлорид-анион (Cl-). На практике в этой реакции участвуют не только два атома, но и огромное неопределенное количество атомов, которые образуют кристаллическую решетку кубической формы, как показано ниже:
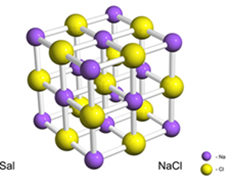
Если мы посмотрим на кристаллы соли в сканирующий электронный микроскоп, мы увидим, что они на самом деле кубические из-за своей внутренней структуры.

Поскольку каждое ионное соединение состоит из неопределенного и очень большого числа ионов, как мы можем представить ионное соединение?
Обычно используется формула формула единицы измерения, который представляет собой пропорцию, выраженную наименьшим возможным количеством катионов и анионов, которые составляют кристаллическую решетку, так что общий заряд соединения нейтрализуется. Для этого необходимо, чтобы количество электронов, отданных одним атомом, было равно количеству электронов, полученных другим атомом.
Некоторые аспекты формулы единицы ионных соединений важны, см. Некоторые из них:
- Всегда сначала пишите катион, а затем анион;
- Поскольку каждое ионное соединение электрически нейтрально, заряды отдельных ионов записывать не нужно;
- Цифры в нижнем индексе справа от каждого иона указывают соотношение атомов катиона и аниона. Эти числа называются индексами, и цифра 1 не пишется.
Например, в случае хлорида натрия у нас есть формула его единицы NaCl, так как у нас есть ровно 1 катион натрия на каждый хлорид-анион.
См. Другой пример, Al3+ имеет три положительных заряда, а F- у него только один минус, поэтому для нейтрализации соединения необходимы три аниона фтора. Таким образом, мы заключаем, что его единичная формула - это AlF3.
Простой способ прийти к формуле единицы ионного соединения - это заменить его заряды на его индексы, как в общем виде показано ниже:
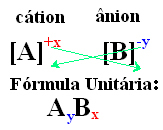
Примеры:

Другая формула, используемая для представления ионных веществ, - это Формула Льюиса или же электронная формула, какие представляет электроны из валентной оболочки ионов «шариков» вокруг символа элемента. В случае с солью мы имеем:

Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm

