О московий, атомный номер 115, расположенный в 15 группе Периодической таблицы, является одним из последних элементов, включенных в нее, в 2015 году, наряду с элементами 113, 117 и 118. Его название является отсылкой к региону г. Москва, российская столица.
Однако московий был первоначально получен в 2003 году в результате совместной работы российских и американских ученых. Несмотря на это, спустя почти 20 лет после его первоначального синтеза его основные свойства все еще определяются. Таким образом, много спекуляций и мало что известно о его свойствах.
Узнать больше: Названия новых химических элементов — дань уважения городам, регионам и ученым
реферат о московии
Это синтетический химический элемент, расположенный в группе 15 Периодическая таблица.
Впервые он был синтезирован в 2003 году совместными усилиями российских и американских ученых.
Он составляет группу элементов, недавно включенных в Периодическую таблицу, в 2015 году.
Их исследования начались совсем недавно, а основные свойства еще не определены.
Его производство происходит путем ядерного синтеза с использованием 48Ca и атомы 243Являюсь.
Недвижимость в Москве
Символ: Мак
Атомный номер: 115
Атомная масса: 288 а.е.м. (не официально от Iupac)
Электронная конфигурация: [Рн] 7с2 5f14 6д10 7р3
Самый стабильный изотоп: 288Mc (период полураспада 0,159 секунды)
химический ряд: группа 15, сверхтяжелые элементы
Особенности Московии
москвиус включен один из последних элементовс в периодической таблице. Его включение состоялось 30 декабря 2015 г., а официальное название было опубликовано 8 июня 2016 г.
До этой даты элемент 115 был известен на португальском языке как ununpentio, от латинского, унунпентий, перевод которого «один, один, пять». Другой принятой номенклатурой был эка-висмут, что означает «похожий на висмут», элемент шестого периода группы 15.
Московия – это синтетический элемент, а это значит, что его можно произвести только в лаборатории. Это очень распространено среди сверхтяжелых элементов, потому что их ядро с большим количеством протонов и нейтронов не может стабилизироваться, что делает невозможным их обнаружение в природе.
за то, что нестабильный элемент, он и другие сверхтяжелые элементы почти мгновенно подвергаются радиоактивному распаду — испусканию частиц. ядерные элементы (такие как α- или β-частицы) — и последующее превращение в другие более легкие элементы, которые могут быть стабильными или нет.
В отношении него следует отметить, что его исследования совсем недавно, ведь перед нами элемент, произведенный чуть менее 20 лет назад и официальному статусу которого нет и 10 лет. В связи с этим ученые были больше озабочены определением основных характеристик, таких как их атомная масса и его химическое поведение в некоторых возможных соединениях.
Например, наиболее вероятная атомная масса, обнаруженная до сих пор для мусковии, составляет 288 атомных единиц массы. Не говоря уже о том, что получить мусковиум очень сложно, с доход только от одного атом в день.
Кроме того, образовавшийся атом не всегда можно зафиксировать для измерения массы. В 2018 году исследователи из Berkeley Laboratories, Калифорния, США, смогли измерить только одну массу тела в неделю. Таким образом, исследования свойств его соединений все еще находятся в области теоретической химии., с расчетами и математическими моделями для определения ожидаемых результатов.
Получение Московии
Получение московиума осуществляется Термоядерная реакция. ионы 48Здесь11+ (Z = 20) ускоренных ударных атомов 243Am (Z = 95), расположенная в виде AmO2 по круглой мишени титан площадью 32 см², образуя московий (Z = 115) и три нейтрона.
После удара примерно через микросекунду (10-6 во-вторых), атом мусковии попадает в детектор, который находится примерно в четырех метрах от места столкновения. На этом пути элемент также проходит через сепаратор, так что более легкие продукты реакции отводятся. В детекторе мусковий обнаруживается по картине радиоактивного распада.
Московий, как радиоактивный атом, подвергается альфа-распаду (радиоактивная частица с двумя протонами и двумя нейтронами), в результате чего образуется элемент 113 (нихоний, Nh) до элемента 105 (дубний, Дб). Наконец, Db превращается в резерфордий (Rf), который быстро распадается на два фрагмента. Схема распада московия показана ниже.
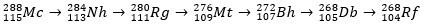
история москвы
Москвич был впервые синтезирован в 2003 г., в период с 14 июля по 10 августа, благодаря совместной работе ученых из Объединенного института для ядерных исследований в Дубне, Россия, и Ливерморской национальной лаборатории им. Лоуренса в Ливерморе, Калифорния.
Ионы 48Ca, чтобы они могли столкнуться с атомами 243Am, первоначально производивший изотоп 291Мак. Во время процесса ядро было нагрето до невероятных 4 x 1011 К, а затем охлаждается за счет очень быстрого испускания трех нейтронов и гамма-лучей.

Это действие образовало изотоп 288Мак. тогда московий был обнаружен и проанализирован на основе его картины радиоактивного распада (альфа-распад). Название Москва – это дань Московской области, Россия.
Читайте также:Сиборгий — синтетический химический элемент, названный в честь ученого Гленна Сиборга.
Решенные упражнения на мусковиус
Вопрос 1
Московий, недавно открытый элемент, был помещен в группу 15 периодической таблицы. Основываясь на других элементах этой группы, ожидаемый гидрид для этого элемента будет:
А) МакХ
Б) МакХ2
С) МакХ3
Г) МакХ4
Е) Мак2ЧАС3
Разрешение:
Альтернатива С
Другие элементы группы 15, такие как азот Это люминофор, представим формулы NH3 и рН3 при соединении с водородом. Таким образом, ожидается, что московий представлен формулой McH3 также.
вопрос 2
В 2003 году совместными усилиями российских и американских ученых впервые был синтезирован московий (Z = 115). В то время изотоп 288Мк был обнаружен, и его производство было необходимо для включения этого элемента в периодическую таблицу. Количество нейтронов в этом изотопе:
А) 115
Б) 288
С) 403
Г) 173
Д) 170
Разрешение:
Альтернатива D
Количество нейтроны можно рассчитать так:
А = Z + п
Где A — массовое число, Z — атомный номер, а n — количество нейтронов. Подставляя значения, получаем:
288 = 115 + н
п = 288 – 115
п = 173
Стефано Араужо Новаис
Учитель химии
