реакции с основные оксиды химические явления, при которых вещество этого класса оксидов помещается в тот же контейнер, что и неорганическая кислота, а кислотный оксид или один амфотерный оксид.
Смотрите также:Реакции с амфотерными оксидами
неорганическая соль и вода - общие продукты в реакция с основными оксидами. Чтобы узнать, будет ли производиться неорганическая соль или вода, мы должны посмотреть на вещество, которое сопровождает основной оксид в реагенте. Посмотрите примеры ниже и поймите, как происходит этот процесс.
Реакции с основными оксидами и неорганическими кислотами
В реакциях между основными оксидами и неорганическими кислотами образуется неорганическая соль и вода, поскольку катион основного оксида (Y+) взаимодействует с анионом (X-) кислоты и катиона гидроксония (H+) кислоты взаимодействует с анионом оксида:
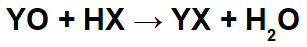
Пример: Оксид радия и бромистоводородная кислота
В этой реакции в качестве реагентов используются оксид радия (RaO) и бромистоводородная кислота (Hbr). Таким образом, происходят следующие взаимодействия:
Радиокатион (Ra+2) с бромид-анионом (Br-1) с образованием соли бромида радия (RaBr2).
Катион гидроксония (H+1) с оксидным анионом (O-2) образуя воду (H2О).
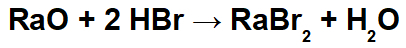
Смотрите также:Реакции с двойными оксидами
Реакции с основными оксидами и кислотными оксидами
В этих реакциях неорганическая соль образуется за счет взаимодействия между основным катионом оксида (Y+) и образовавшийся кислотный анион (WOВ-) химической реакции между оксидом кислоты и водой.
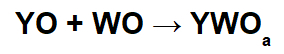
Пример: Оксид натрия и диоксид серы
В этой реакции мы имеем оксид натрия (Na2O) и диоксид серы (SO2). Примечательно, что первоначально при взаимодействии кислотного оксида с водой происходит образование сернистой кислоты (H2ТОЛЬКО3):
Не останавливайся сейчас... После рекламы есть еще кое-что;)

Из-за образования этой кислоты взаимодействие между катионом натрия (Na+1) основного оксида и сульфит-аниона (SO3-2) кислоты, образуя соль сульфита натрия (Na2ТОЛЬКО3):
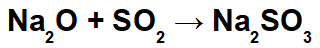
Реакции с основными оксидами и амфотерными оксидами
Амфотерные оксиды - это вещества, которые проявляют двойное химическое поведение: в присутствии кислого вещества оно ведет себя как основной оксид; в присутствии вещества основного характера он ведет себя как оксид кислоты.
Итак, когда основной оксид реагирует с амфотерным оксидом, он будет вести себя как оксид кислоты, образуя неорганическую кислоту в присутствии воды. Реакция между анионом неорганической кислоты и катионом основного оксида дает солевой продукт.
Пример: Оксид калия и оксид хрома III
В этой реакции в качестве реагентов используется оксид калия (K2O) и оксида хрома (Cr2О3). Примечательно, что первоначально при взаимодействии амфотерного оксида с водой происходит образование хромосомной кислоты (2HCrO2):

В результате образования этой кислоты происходит взаимодействие между катионом калия (K+1) основного оксида и хромит-аниона (SO3-2) кислоты, образуя соль хромита калия (2KCrO2):

Автор: Диого Лопес Диас
Хотели бы вы ссылаться на этот текст в учебе или учебе? Смотреть:
ДНИ, Диого Лопес. «Реакции с основными оксидами»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm. Доступ 27 июля 2021 г.
Номенклатура солей, классификация солей, название аниона, название катиона, сульфат железа, сульфат железа, нитрат серебра, хлорида калия, хлорида натрия, хлорида кальция, нитрата серебра, сульфата меди, карбоната кальций.



