Нитраты - это неорганические соединения, содержащие анион NO3-.
Азот относится к семейству 15, имеет 5 электронов в валентной оболочке и должен образовать три ковалентные связи. (с разделением электронов) иметь восемь электронов в валентной оболочке и, таким образом, иметь стабильный. Однако каждый кислород имеет 6 электронов в последней оболочке, и поэтому каждый из его атомов должен образовать две связи, чтобы быть стабильными.
Итак, в нитрат-анионе азот является центральным элементом, который образует двойную связь с одним из атомов кислорода, который является стабильным, одинарная связь с одним из двух других атомов кислорода, а с другим - ковалентная связь дательный. Это означает, что один из атомов кислорода нестабилен, ему необходимо получить еще 1 электрон, что дает общий заряд, равный -1. С дативным азотом образует связь больше, чем он мог бы сделать, отдавая один из своих электронов, получая заряд, равный +1. См. Структуру этого аниона ниже:
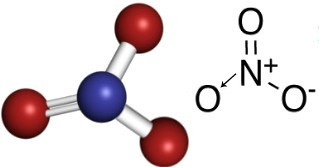
Этот анион может получить электрон и образовать электрически нейтральное соединение, неорганическую соль. Все эти соединения растворимы в воде.
Основное применение нитратов - лекарства, такие как вазодилататоры, при лечении стенокардии (боли в вызвано недостаточным притоком кислорода к сердечной мышце) и эректильной дисфункцией мужчина. Они также используются в удобрениях и взрывчатых веществах, как будет упомянуто позже.
Нитраты могут быть получены посредством реакции нейтрализации азотной кислотой (HNO).3) с некоторой базой. См. Пример ниже, где образовался нитрат магния:
HNO3 + Mg (ОН)2 → Mg (НЕТ3)2+ H2О
Три основных примера соединений этого типа: нитрат натрия (NaNO3), нитрат калия (KNO3) и нитрата аммония (NH4НА3). Во всех этих случаях катионы (Na+, К+ и NH4+) предоставляют 1 электрон нитрат-аниону. Но на самом деле эти противоположные заряды притягиваются друг к другу и образуют четко определенные ионные кластеры, которые являются кристаллическими решетками. Таким образом, нитраты обычно представляют собой твердые кристаллические вещества, как показано ниже в случае нитрата натрия:
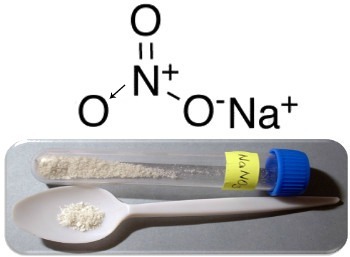
Это соединение используется при производстве удобрений, но в основном оно известно как Чилийская селитра, так как в чилийских пустынях есть большие его месторождения. Он превращается в нитрат калия, из которого делают черный порох, используемый в различном оружии и взрывчатых веществах.

И нитрат натрия, и нитрат калия, называемые «селитрой», широко используются в качестве консерванты цвета консервов и копченостей, а также в некоторых продуктах для придания большего ощущения сытость. Однако его потребление наносит серьезный вред здоровью, так как эти нитраты могут трансформироваться бактериями из организм в нитриты, а затем в нитрозамины, которые являются канцерогенными, в основном вызывая рак в желудок. Нитриты также преобразуют гемоглобины в крови, что делает их неспособными переносить кислород.
Основные причины избыточного поступления нитратов - использование азотных удобрений при выращивании овощей.
Селитра опасна еще и тем, что увеличивает концентрацию ионов натрия в организме, что может вызвать проблемы с сердцем, например, высокое кровяное давление.
О нитрат аммония он также используется в качестве удобрения и взрывчатого вещества и даже использовался с мазутом во время террористической атаки на здания Всемирного торгового центра 11 сентября 2001 года.

При нападении на Всемирный торговый центр использовалась аммиачная селитра *
* Авторское право на изображение: Дэн Хауэлл а также Shutterstock.com
Дженнифер Фогача
Окончила химический факультет
