В макаронные изделияатомный как следует из названия, это масса атома, обычно обозначаемая буквой «mВ»Или« МА ». Однако, поскольку атом - чрезвычайно маленькая сущность, невидимая для человеческого глаза, невозможно измерить его массу, например, с помощью весов. Поэтому ученые определили массу атомов, сравнив их с массами других атомов.
То же самое и с другими единицами. Например, единицей массы является стандартный килограмм, что соответствует цилиндру высотой и диаметром 3,917 см, состоящему из 10% иридия и 90% платины. Так что это служит для сравнения. Например, если мы «взвешиваем» объект на весах и обнаруживаем, что его масса составляет 10 кг, это означает, что его масса в 10 раз больше, чем выбранный стандарт: 1 кг.
То же самое и с атомами. В качестве стандарта был выбран углерод-12, и этому атому произвольно присвоили массу 12 ед. «U» - единица атомной массы и, следовательно, эквивалентна 1/12 массы атома углерода.
Например, когда мы говорим, что атомная масса водорода равна 1 u, это означает, что это как если бы если мы разделим углерод на 12 частей, масса одной из этих частей будет эквивалентна массе атома водород. Другой пример - сера, ее атомная масса 32 u, что означает, что ее масса в 32 раза больше, чем 1/12 массы
12Ç.1 u = 1/12 массы 1 атома углерода 12

Атомная единица массы составляет 1/12 массы углерода-12.
Молекулярная масса веществ - это сумма атомных масс элементов. Например, атомная масса кислорода равна 16 ед., Поэтому молекулярная масса молекулы газообразного кислорода (O2) равно 32u.
Поскольку лабораторные методы в настоящее время очень развиты, существуют устройства, которые точно измеряют атомную массу элементов, например масс-спектрометр. Таким образом, можно узнать, что 1 u равно 1,66054. 10-24 грамм.
Интеллектуальная карта: атомная масса

* Чтобы скачать интеллектуальную карту в формате PDF, кликните сюда!
Поскольку атомные массы определены с большой точностью, они приведены в периодической таблице в виде десятичных чисел. Но когда мы идем делать вычисления, мы обычно используем округленное число, за исключением экспериментов, которые должны быть очень точными. Например, если вы посмотрите на Периодическую таблицу, вы увидите, что атомная масса кислорода равна 15 999 u, но мы обычно используем значение 16 u в расчетах. То же самое происходит и с углеродом, атомная масса которого равна 12,01 u, как показано ниже:
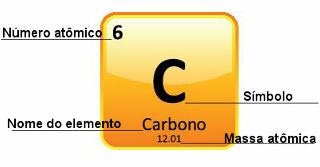
Представление углерода в Периодической таблице
Элементы, которые появляются в Периодической таблице, на самом деле являются средневзвешенными значениями всех природных изотопов элемента. Таким образом, атомная масса, указанная в таблице, также является средней атомной массой этих элементов. Например, хлор (C?) Имеет два природных изотопа, 35 и 37, соответствующие процентные содержания которых в природе составляют 75,76% и 24,24%. Атомные массы каждого из этих изотопов различны: атомная масса C? -35 составляет 34,96885 ед., А масса C? -37 - 36,96590.
Таким образом, атомная масса элемента рассчитывается с учетом массы каждого изотопа и его распространенности в природе. В случае хлора мы имеем:
Атомная масса элемента хлора = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Атомная масса элемента хлора = 35,45
Это значение атомной массы хлора, которое отображается в Периодической таблице.
* Ментальная карта. Автор: Диого Лопес.
Дженнифер Фогача
Окончил в письмах
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
