В энтальпия термодинамическая функция, с помощью которой вычисляет тепло, участвующее в изобарических процессах, то есть находящиеся под постоянным давлением. Его развитие произошло вскоре после падения теории калорийности. термодинамика между 1840 и 1850 годами.
Энтальпия для какиеумика, не имеет большого значения, если рассматривается как абсолютное и изолированное значение, но имеет значение при рассмотрении изменение его значения в химическом процессе. Есть несколько способов рассчитать изменение энтальпии процесса, основные из которых - через энергии образования, связывания, а также тамэй из хесса.
Читайте тоже: Что такое свободная энергия Гиббса?
Сводка энтальпии
Энтальпия - это термодинамический инструмент для расчета тепла, участвующего в процессах, происходящих при постоянном давлении.
Его определил американский физик Джозайя У. Гиббс в контексте падения теории калорийности.
В химии мы всегда используем изменение энтальпии, представленное как ΔH.
Химические реакции с поглощением тепла называются эндотермическими и имеют ΔH> 0.
Химические реакции с выделением тепла называются экзотермическими и имеют ΔH <0.
Видеоурок по энтальпии
Что такое энтальпия?
Энтальпия, всегда обозначаемая H, изначально была определено американским физиком Джозайей Уиллардом Гиббсом, которую он назвал функцией тепла при постоянном давлении, поскольку, по его словам:
«[…] Уменьшение функции во всех случаях, когда давление не меняется, представляет собой тепло, отдаваемое системой».
Таким образом, из работы Гиббса мы можем понять энтальпию как термодинамическую функцию, вариация численно равна количеству теплообмена в системе, чтобы давление постоянный. Это означает, что в изобарических процессах (как и в большинстве химических процессов) знание рассчитать изменение функции энтальпии, тогда можно узнать значение теплообмена между системой и район.

Такая корреляция с жарой вызывает многие студенты ошибочно думают, что энтальпия является синонимом нагревать или что-то вроде содержания энергии, теплосодержания, выделяемого тепла и поглощенного тепла и т.п.
Энтальпия возникла в контексте краха теории теплоты, которая рассматривала тепло как невесомую материальную субстанцию, которая передается от более теплых тел к более холодным телам. Таким образом, возникла необходимость в новом инструменте для расчета тепла. Тогда решение заключалось в использовании величин, которые уже были определены термодинамическими уравнениями, таких как энтальпия.
Читайте тоже: Как рассчитать изменение энтальпии раствора?
изменение энтальпии
Поскольку энтальпия - это инструмент, используемый для расчета теплообмена в химическом процессе, нет смысла использовать ее как абсолютное изолированное число, но учитывая его вариацию, то есть на практике, мы должны только оценить, насколько численно энтальпия изменилась во время химического процесса, поскольку термодинамика уверяет нас, что ее вариация численно равно количеству тепла, выделяемого или поглощаемого в процессе.
Строго говоря, мы можем определить изменение энтальпии как:
ΔH = HФинал - Hисходный
Как и в химических процессах, конечной стадией можно считать продукты, а начальной стадией - реагенты. Также принято рассматривать определение вариации энтальпии как:
ΔH = Hпродукты - Hреагенты
С практической и интерпретационной точки зрения, если изменение энтальпии положительное (ΔH> 0), мы говорим, что химическая реакция эндотермический, то есть на протяжении всего процесса происходит поглощение тепла. Уже если изменение энтальпии отрицательное (ΔH < 0), мы говорим, что химическая реакция экзотермический, то есть тепло выделяется на протяжении всего процесса.
Изменение энтальпии во многих случаях наблюдается на графиках, как показано в следующих примерах.
Пример 1:
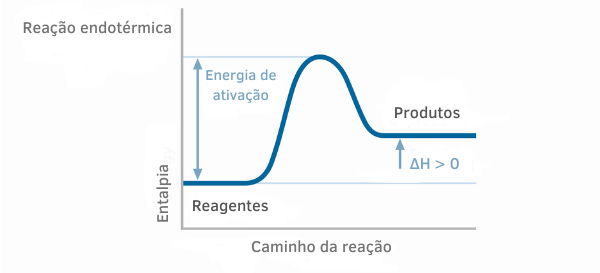
Диаграмма эндотермической реакции
На графиках энтальпии для эндотермических реакций можно видеть, что количество энтальпии продуктов больше, чем у реагентов, что указывает на положительное изменение по ходу реакции. Таким образом, если ΔH> 0, можно сказать, что химический процесс происходил с поглощением тепла.
Пример 2:
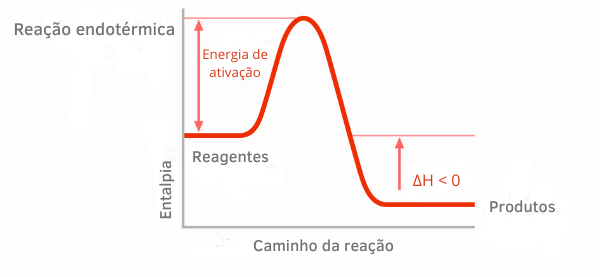
Диаграмма экзотермической реакции:
На графиках энтальпии экзотермических реакций можно увидеть, что количество энтальпии продуктов меньше, чем у реагентов, что указывает на отрицательное изменение по ходу реакции. Таким образом, поскольку ΔH <0, можно сказать, что химический процесс происходил с выделением тепла.
Подробнее об этих классификациях химических реакций читайте в тексте: ДЛЯэндотермические и экзотермические процессы.
Типы энтальпии
энтальпия образования
В энтальпия образования é рассчитанный на основе химические реакции образования, которые представляют собой реакции, в которых один моль сложных веществ образуется из их наиболее стабильных простых веществ при комнатной температуре и давлении 1 атмосфера.
ЧАС2(г) + ½ O2 (г) → H2O (l) H °ж = -286 кДж / моль
Большое преимущество энтальпии образования состоит в том, что простые вещества, которые более стабильны при комнатной температуре и давлении в 1 атмосферу, имеют согласованную с нулем энтальпию. Это не означает, что они на самом деле равны нулю, но для упрощения и лучшей классификации они рассматриваются так.
Существование ЧАС = Hпродукты - Hреагенты, если учесть, то Hреагенты = 0, можно сказать, что наблюдаемое значение ΔH относится только к продуктам, которые в этих случаях всегда представляют собой один моль составного вещества. Поэтому мы указываем это значение как стандартное изменение энтальпии образования воды, представленное как ΔH °ж.
Именно с помощью этой методологии у некоторых веществ были свои вариации стандартная энтальпия таблицы формирования, как мы видим ниже.
Вещество |
Энтальпия образования (ΔH °ж) в кДж / моль |
CO2 (грамм) |
-393,4 |
CaO (ы) |
-634,9 |
HI (г) |
+25,9 |
НЕТ (г) |
+90,1 |
энтальпия связывания
Энтальпия связывания служит для указания количества энергии, участвующей в разрыве или образовании данного моля. химическая связь.
Понятно, что, чтобы разорвать химическую связь, необходимо поглотить тепло, так что связывающие атомы увеличивают внутренняя энергия и, следовательно, увеличить вашу кинетическую энергию. с большим кинетическая энергия, атомы вибрируют более интенсивно, что приводит к разрыву связей. Таким образом, каждый разрыв связи - эндотермический процесс.
В противном случае, чтобы образовать химическую связь, атомы теряют свободу движения и им необходимо уменьшить степень своего движения, уменьшая свою кинетическую энергию. Оставшаяся энергия затем выделяется в виде тепла. Таким образом, все образование связей - экзотермический процесс.
В таблице ниже показаны значения энергий, связанных с каждой химической связью.
Связь |
Энергия связи (кДж / моль) |
C-H |
412,9 |
C-C |
347,8 |
O = O |
497,8 |
П-П |
154,6 |
НЕТ |
943,8 |
Обратите внимание, что в значениях нет знаков, поскольку они указаны по модулю. Это связано с тем, что сигнал должен быть назначен вами в зависимости от того, разорвана ли ссылка или сформирована.
Энтальпия горения
В энтальпия горения служит для обозначения количество тепла, выделяемого при сгорании одного моля вещества. Следует отметить, что каждая реакция горения экзотермична, так как при каждом горении выделяется тепло.
CH4 (г) + 2 O2 (г) → CO2 (г) + 2 H2ΔH °Ç = -889,5 кДж / моль
В таблице ниже приведены значения энтальпии сгорания некоторых химических веществ.
Вещество |
Энтальпия горения (ΔH °Ç) в кДж / моль |
Этанол - C2ЧАС5ОН (1) |
-1368 |
Бензол - C6ЧАС6 (1) |
-3268 |
Октан - C8ЧАС18 (1) |
-5471 |
Глюкоза - C6ЧАС12О6 (s) |
-2808 |
Энтальпия изменения физического состояния
Каждое изменение физического состояния связано с теплообменом. Следовательно энтальпия изменения физического состояния служит для обозначения количество тепла, участвующего в процессах изменения физического состояния.
Например, у нас есть испарение воды:
ЧАС2O (1) → H2O (г) ΔH = +44 кДж / моль
При таянии воды мы имеем:
ЧАС2O (т) → H2O (л) ΔH = +7,3 кДж / моль
Значения энтальпии симметричны для обратных процессов., что означает, например, что изменение энтальпии при сжижении воды составляет -44 кДж / моль, а при ее затвердевании - -7,3 кДж / моль.
Читайте тоже: Что такое энтропия?
Решенные упражнения на энтальпию
Вопрос 1 - (UERJ 2018) Загрязняющая способность углеводорода, используемого в качестве топлива, определяется соотношением между высвобождаемой энергией и количеством CO.2 образуется при его полном сгорании. Чем выше коэффициент, тем меньше загрязняющая способность. В таблице ниже приведены стандартные энтальпии сгорания четырех углеводородов.

Из таблицы углеводороды с наименьшей загрязняющей способностью:
Октан
Гексан
Бензол
пентан
разрешение
Альтернатива D
Вопрос указывает на то, что загрязняющая способность определяется как отношение (частное) между выделенной энергией и количеством CO.2 образуется при его полном сгорании. Чем больше причина, чем ниже загрязняющая способность, то есть больше энергии выделяется на моль CO2 сгенерировано.
Реакции полного сгорания Углеводороды цитируются:
Октан: Ç8ЧАС18 +25/2 O2 → 8 СО2 + 9 часов2Причина: 5440/8 = 680
Гексан: Ç6ЧАС14 +19/2 O2 → 6 СО2 + 7 часов2Причина: 4140/6 = 690
Бензол: Ç6ЧАС6 + 15/2 O2 → 6 СО2 + 3 часа2Причина: 3270/6 = 545
пентан: Ç5ЧАС12 + 8 O2 → 5 СО2 + 6 часов2Причина: 3510/5 = 702
Таким образом, можно сделать вывод, что пентан является углеводородом с наименьшей загрязняющей способностью.
Вопрос 2 - (Enem 2015) Использование лесных остатков становится все более привлекательным с каждым днем, поскольку они являются возобновляемым источником энергии. На рисунке показано сжигание биомасла, полученного из древесных отходов, где ΔH1 изменение энтальпии из-за сгорания 1 г этого биомасла, в результате чего образуется диоксид углерода и жидкая вода, и ΔH2 изменение энтальпии, участвующее в превращении 1 г воды из газообразного состояния в жидкое состояние.

Изменение энтальпии в кДж для сжигания 5 г этого биомасла с образованием CO2 (газообразный) и H2(Газообразный):
А) -106
Б) -94
В) -82
Г) -21,2
E) -16,4
разрешение
Альтернатива C
Из представленного графика имеем ΔH1 как изменение энтальпии сжигания биомасла с образованием CO2 (g) и H2O (1) и ΔH2 как изменение энтальпии разжижения воды, так как CO2 остается газообразным, и только физическое состояние Воды меняется (с газа на жидкость).
В упражнении требуется изменение энтальпии сжигания 5 г биомасла, в результате чего образуется CO.2 (газообразный) и H2О (газообразный). Из диаграммы это изменение энтальпии можно определить как ΔH = ΔH1 - H2. Таким образом, значение ΔH будет равно -16,4 кДж / г. Это изменение, как мы можем видеть в единицах измерения, относится к КАЖДОМУ грамму биомасла. Для 5 граммов мы должны сделать пропорция:
1 г биомасла -16,4 кДж
5 г биомасла x
1. х = 5. (-16,4)
x = -82 кДж
Затем мы можем отметить альтернативу C.
Стефано Араужо Новаис
Учитель химии

