Окисление это название, данное процессу потери электронов атомом, группой или ионами во время химическая реакция. Это определяется по увеличению NOX (степень окисления) вида или атома при сравнении реагента и продукта.
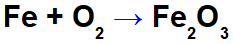
Уравнение окисления железа.
В приведенном выше уравнении, например, мы можем указать NOX каждого из участников:
Реагентное железо (Fe): содержит NOX 0, поскольку простая субстанция;
Кислород в реагенте (O): содержит NOX 0, так как это простое вещество;
Кислород в продукте: в нем есть NOX -2, потому что он не связан с щелочным металлом, щелочноземельный или образование водорода перекиси или супероксиды;
Железо в продукте: в нем NOX +3, потому что сумма NOX железа, умноженная на 2 (количество атомов) + NOX кислорода, умноженная на 3, должна дать 0, поскольку это составное вещество:
х.2 + 3. (- 2) = 0
2x - 6 = 0
2x = +6
х = + 6
2
х = +3
Сравнивая NOX реагентного железа (0) с продуктом (+3), мы наблюдали увеличение, то есть оно подвергалось процессу окисление. Стоит отметить, что возникновение
окисление это всегда сопровождается явлением восстановления (что означает увеличение количества электронов), определяемым уменьшением NOx, как это происходит с кислородом в примере.Читайте тоже:Определение числа окисления (NOX)
Примеры ситуаций, в которых происходит окисление:
1. Горение

Горение материала также свидетельствует об окислении.
Горение каждая химическая реакция, происходящая в присутствии топливо любой и окисляющий газообразный кислород (O2), в результате чего выделяется тепло и свет. В каждой реакции горения происходит окисление.
2. Некоторые органические реакции
В каждой органической реакции, протекающей в присутствии перечисленных ниже средств, процесс окисление:
Дихромат калия (K2Cr2О7) или перманганат калия (KMnO4);
Наличие сильной кислоты или сильного основания;
Озоновый газ (O3) в присутствии металлического цинка (Zn) и воды (H2О).
3. Батарейки или батарейки

Батареи - это устройства, в которых всегда происходит окисление.
Стеки или батареи - это электрохимические устройства, в которых хранятся химические вещества. Одно из этих веществ подвергнется окислению, а другое - восстановлению, что приведет к образованию электрического тока.
4. Электролиз
Электролиз представляет собой химический процесс, при котором водный раствор, содержащий соль, подвергается воздействию электрического тока, который в конечном итоге способствует окислению анионов, присутствующих в этих материалах. Во всех электролизах есть окисление.
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm

