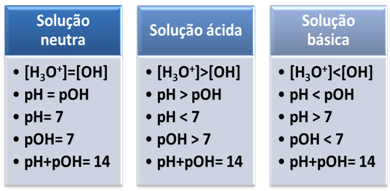
Среда считается нейтральной, если она имеет одинаковую концентрацию в моль / л ионов гидроксония (H3О+) и гидроксид (OH-).
Примером нейтральной среды, которая даже служит стандартом для других растворов, является чистая дистиллированная вода с температурой 25 ° C. При этой температуре у него ровно 1. 10-7 моль / л обоих ионов. Следовательно, ваш ионный продукт (Kш) равно 10-14 (Молл)2:
Kш = [H3О+]. [ой-]
Kш = (1. 10-7 Молл). (1. 10-7 моль / л) = 10-14 (Молл)2
PH и pOH приведены ниже:
pH = - log [H3О+] pOH = -log [OH-]
pH = - log 1. 10-7 pOH = - log 1. 10-7
pH = 7рОН = 7
Это показывает нам, что в нейтральном растворе pH равен pOH.
- Кислая среда:
В кислой среде концентрация ионов H3О+ больше, чем у ионов ОН-.
Такого решения можно добиться, добавив небольшую часть ионов H3О+, например, с помощью кислоты.
Согласно принципу Ле Шателье, когда в системе, находящейся в состоянии равновесия, возникает нарушение, она имеет тенденцию к корректировке, чтобы уменьшить воздействие этой силы. Это означает, что если в воду добавить кислоту, ионы H
3О+ они будут в избытке, и баланс сместится в обратном направлении реакции, влево. Таким образом, эти избыточные ионы будут реагировать с ионами OH.-. Таким образом, концентрация ионов ОН- уменьшится, и раствор станет кислым.
Ионное произведение (кВт) всегда равно 10-14, но концентрация ионов H3О+ больше, чем концентрация ионов ОН-1. Следовательно, pH больше, чем pOH в кислой среде, но его сумма всегда равна 14.
Кроме того, чем больше концентрация ионов H3О+, тем больше значение pH. При комнатной температуре (25 ° C), pH <7 и pOH> 7.

- Основные средства:
В основной среде концентрация ионов ОН- больше, чем у ионов H3О+.
Если мы добавляем основание в воду, это означает, что мы добавляем ионы ОН.- и, как объяснялось в предыдущем пункте, по принципу Ле Шателье, равновесие реакции самоионизация воды будет двигаться в противоположном направлении, при этом избыточные ионы будут реагировать с Ионы H3О+, снижая концентрацию и делая раствор основным.
В этом случае pOH будет больше, чем pH. При комнатной температуре (25 ° C), pH> 7 и pOH <7.

Вкратце:
Дженнифер Фогача
Окончила химический факультет

