КП это аббревиатура, используемая для определения константа равновесия с точки зрения парциальных давлений. Эта константа работает, например, со значениями газообразных участников равновесия в атм.

Уравнение, представляющее химическую реакцию с газообразными компонентами
В этом уравнении все участники являются газами, поэтому, когда участвующий газ имеет парциальное давление в смеси, он обозначается аббревиатурой pX.
При составлении уравнения химического равновесия (в терминах концентрации) продукты должны быть помещены в числитель, а реагенты - в знаменатель:
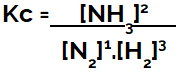
Kc выражение равновесия образования аммиака
выражение константа равновесия по давлению (Kp) следует образцу Kc, то есть парциальные давления реагентов указаны в знаменателе, а парциальные давления продуктов - в числителе:
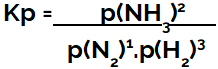
Kp выражение равновесия образования аммиака
Наблюдение: Если уравнение реакции химический баланс не представляйте газообразный участник, он не будет автоматически представлять КП.
Пример: (PUC-MG) Для реакции: 2 CO(грамм)
+ O2 (г)? 2 CO2 (г), парциальные давления CO(грамм) это2 (г) в равновесии они составляют соответственно 0,2 атм и 0,4 атм. Общее давление в системе 1,4 атм. Значение КП для реакции:а) 56,2
б) 40,0
в) 35,6
г) 28,4
д) 25,6
Данные, полученные в ходе упражнения:
Парциальное давление окиси углерода (pCO) = 0,2 атм;
Парциальное давление окиси углерода (pO2) = 0,4 атм;
Общее давление = 1,4 атм;
Чтобы определить КП этой системы, мы должны выполнить следующие шаги:
1-й шаг: Определите парциальное давление окиси углерода (pCO2).
Для этого просто помните, что полное давление (pt) - это сумма всех парциальных давлений:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 атм
2-й шаг: Определите Kp упражнения.
Для этого просто используйте значения в выражении константы равновесия Kp:
Kp = (pCO2)2
(pCO)2.(пыль2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
КП = 40 атм-1
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm