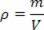Термодинамика - это область физики, изучающая передачу энергии. Он пытается понять взаимосвязь между теплом, энергией и работой, анализируя количество передаваемого тепла и работу, выполняемую в физическом процессе.
Изначально термодинамическая наука была разработана исследователями, которые искали способ улучшить машины в период промышленной революции, повысив их эффективность.
Эти знания в настоящее время применяются в различных ситуациях нашей повседневной жизни. Например: тепловые машины и холодильники, автомобильные двигатели и процессы переработки полезных ископаемых и нефтепродуктов.
Законы термодинамики
Фундаментальные законы термодинамики определяют, как тепло превращается в работу, и наоборот.
Первый закон термодинамики
THE Первый закон термодинамики относится к принцип сохранения энергии. Это означает, что энергия в системе не может быть разрушена или создана, а только преобразована.
Формула, представляющая первый закон термодинамики, выглядит следующим образом:

Количество тепла, работа и изменение внутренней энергии имеют стандартную единицу измерения Джоуль (Дж).
Практический пример энергосбережения: когда человек использует насос для надувания надувного объекта, он использует силу, чтобы нагнетать воздух в объект. Это означает, что кинетическая энергия заставляет поршень опускаться. Однако часть этой энергии превращается в тепло, которое теряется в окружающей среде.
THE Закон Гесса является частным случаем принципа сохранения энергии. Узнать больше!
Второй закон термодинамики
В теплопередача они всегда происходят от самого теплого тела к самому холодному телу, это происходит спонтанно, но не наоборот. То есть процессы передачи тепловой энергии необратимы.
Таким образом, Второй закон термодинамики, невозможно полностью преобразовать тепло в другую форму энергии. По этой причине тепло считается деградированной формой энергии.

Физическая величина, связанная со вторым началом термодинамики, - это энтропия, что соответствует степени беспорядка в системе.
Читайте тоже:
- Цикл Карно
- Термическое расширение
Нулевой закон термодинамики
THE Нулевой закон термодинамики занимается условиями получения тепловой баланс. Среди этих условий можно упомянуть влияние материалов, повышающих или понижающих теплопроводность.
Согласно этому закону,
- если тело A находится в тепловом равновесии при контакте с телом B и
- если это тело A находится в тепловом равновесии при контакте с телом C, то
- B находится в тепловом равновесии при контакте с C.
Когда два тела с разными температурами соприкасаются, одно из них более теплое будет передавать тепло другому, более холодному. Это приводит к выравниванию температур, достигающих тепловой баланс.
Он называется нулевым законом, потому что его понимание оказалось необходимым для первых двух законов, которые уже существовали - первого и второго законов термодинамики.
Третий закон термодинамики
THE Третий закон термодинамики это выглядит как попытка установить абсолютную точку отсчета, определяющую энтропию. Энтропия на самом деле является основой Второго закона термодинамики.
Вальтер Нернст, физик, который предложил это, пришел к выводу, что чистое вещество с нулевой температурой не может иметь энтропию с приблизительным нулевым значением.
По этой причине это противоречивый закон, который многие физики считают правилом, а не законом.
термодинамические системы
В термодинамической системе может быть одно или несколько связанных тел. Окружающая среда и Вселенная представляют собой среду, внешнюю по отношению к системе. Систему можно определить как открытую, закрытую или изолированную.
 термодинамические системы
термодинамические системы
Когда система открыта, происходит передача массы и энергии между системой и внешней средой. В замкнутой системе происходит только передача энергии (тепла), а в изолированной системе обмена нет.
поведение газов
Микроскопическое поведение газов легче описать и интерпретировать, чем в других физических состояниях (жидких и твердых). Вот почему в этих исследованиях чаще всего используются газы.
В термодинамических исследованиях используются идеальные или совершенные газы. Это модель, в которой частицы движутся хаотично и взаимодействуют только при столкновениях. Кроме того, считается, что эти столкновения между частицами и между ними и стенками контейнера являются упругими и длятся очень короткое время.
В замкнутой системе идеальный газ предполагает поведение, которое включает следующие физические величины: давление, объем и температуру. Эти переменные определяют термодинамическое состояние газа.
 Поведение газов по законам газа
Поведение газов по законам газа
Давление (p) создается движением частиц газа внутри контейнера. Пространство, занимаемое газом внутри контейнера, - это объем (v). А температура (t) связана со средней кинетической энергией движущихся частиц газа.
Тоже читай Закон о газе а также Изучение газов.
внутренняя энергия
Внутренняя энергия системы - это физическая величина, которая помогает измерить, как происходят преобразования газа. Эта величина связана с изменением температуры и кинетической энергии частиц.
Идеальный газ, состоящий только из одного типа атомов, имеет внутреннюю энергию, прямо пропорциональную температуре газа. Это представлено следующей формулой:

Решенные упражнения по термодинамике
Вопрос 1
В цилиндре с подвижным поршнем находится газ под давлением 4,0,10.4Н / м2. Когда в систему подводится 6 кДж тепла при постоянном давлении, объем газа увеличивается на 1.0.10-1м3. Определите проделанную работу и изменение внутренней энергии в данной ситуации.
Правильный ответ: проделанная работа 4000 Дж, изменение внутренней энергии 2000 Дж.
Данные:
п = 4,0.104 Н / м2
Q = 6 кДж или 6000Дж
ΔV = 1,0.10-1 м3
Т =? ΔU =?
1-й шаг: Рассчитать работу с данными о проблеме.
Т = П. ΔV
Т = 4,0,104. 1,0.10-1
Т = 4000 Дж
2-й шаг: Рассчитайте изменение внутренней энергии с новыми данными.
Q = T + ΔU
ΔU = Q - Т
ΔU = 6000 - 4000
ΔU = 2000 Дж
Следовательно, выполненная работа составляет 4000 Дж, а изменение внутренней энергии - 2000 Дж.
вопрос 2
(Адаптировано из ENEM 2011) Двигатель может выполнять работу только в том случае, если он получает некоторое количество энергии от другой системы. В этом случае энергия, запасенная в топливе, частично высвобождается во время сгорания, чтобы прибор мог работать. Когда двигатель работает, часть энергии, преобразованной или преобразованной при сгорании, не может быть использована для работы. Это означает, что есть утечка энергии в другой форме.
Согласно тексту, преобразования энергии, происходящие при работе двигателя, происходят из-за:
а) тепловыделение внутри двигателя невозможно.
б) работа двигателя неконтролируема.
в) полное преобразование тепла в работу невозможно.
г) преобразование тепловой энергии в кинетику невозможно.
д) потенциальное использование энергии топлива неконтролируемо.
Правильная альтернатива: в) полное преобразование тепла в работу невозможно.
Как было замечено ранее, тепло не может быть полностью преобразовано в работу. Во время работы двигателя часть тепловой энергии теряется, передаваясь во внешнюю среду.
Смотри тоже: Упражнения по термодинамике