Атом - это основная единица материи и наименьшая фракция, способная идентифицировать химический элемент, поскольку он сохраняет свою идентичность. Термин «атом» происходит от греческого языка и означает «неделимый».
Он состоит из ядра, которое содержит нейтроны и протоны, и электронов, окружающих ядро.
структура атома
Атом состоит из мелких частиц, также называемых субатомные частицыs: электроны, протоны и нейтроны.
Большая часть массы атома сосредоточена в ядре, небольшой плотной области. Самый большой его объем находится в электросфере, месте пустых пространств, когда электроны вращаются вокруг ядра.
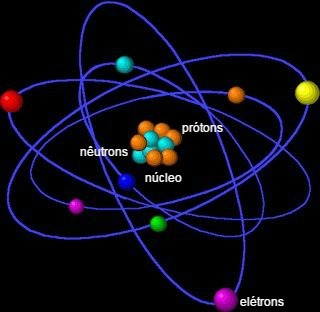
электроны
О электрон он имеет отрицательный электрический заряд (-1) и почти не имеет массы, так как его значение составляет 9,11 x 10-28 g e примерно в 1840 раз меньше массы ядра. Это крошечные частицы, которые очень быстро вращаются вокруг атомного ядра.
Электроны, которые находятся во внешних областях атома, несут ответственность за образование химических связей, которые происходят посредством передачи, приема или совместного использования электронов.
протоны
О протон он имеет положительный электрический заряд (+1) того же абсолютного значения, что и заряд электронов. Таким образом, протон и электрон имеют тенденцию электрически притягиваться друг к другу.
Через протоны можно различать химические элементы, потому что каждый атом элемента имеет определенное количество протонов в своем ядре, которое называется атомный номер.
нейтроны
О нейтрон он вообще не имеет заряда, то есть электрически нейтрален. Вместе с протонами он образует атомное ядро, которое несет на себе всю массу атома (99,9%). И протон, и нейтрон имеют массу примерно 1,67 x 10-24 грамм. Это значение представляет собой атомную единицу массы 1 мкм.
Нейтрон обеспечивает стабильность атомного ядра, поскольку ядерная сила притягивает его к электронам и протонам.
Только у атома водорода нет нейтронов, он состоит только из электрона, вращающегося вокруг протона.
В таблице ниже абстрактный с информацией о субатомных частицах.
| Частицы | Символ |
Макароны (в единицах атомная масса) |
Заряжать (в единицах электрический заряд - u.c.e) |
Место расположения |
|---|---|---|---|---|
| Протон | +1 | основной | ||
| Нейтрон | 0 | основной | ||
| Электрон | -1 | электросфера |
Атом в своем основном состоянии электрически нейтрален, поскольку количество протонов равно количеству электронов, а противоположные заряды, положительный и отрицательный, компенсируют друг друга.
Например, натрий (Na) имеет атомный номер 11, то есть в его ядре 11 протонов. Следовательно, в электросфере атома этого элемента находится 11 электронов.
Узнать больше о атомная структура.
атомный состав
Как мы видели, атом образован небольшой и плотной центральной областью, называемой ядром, а вокруг нее находится электросфера, в которой расположены электроны, которую можно разделить на электронные слои, энергетические подуровни и атомные орбитали.
электронные слои
атом представляет уровни энергии, которые соответствуют семи слоям вокруг ядра, и в них находятся электроны, вращающиеся вокруг него. Слои называются K, L, M, N, O, P и Q.
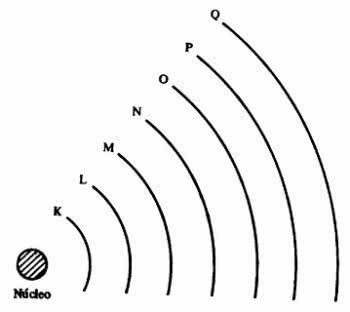
Каждая оболочка может содержать определенное количество электронов, как показано в таблице ниже.
| Уровень энергии | электронный слой | Максимальное количество электронов |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | О | 32 |
| 6º | п | 18 |
| 7º | Q | 8 |
Например, атом гелия (He) имеет атомный номер 2 и, следовательно, имеет 2 протона в ядре. Следовательно, в электросфере атома всего 2 электрона, которые находятся в первой и единственной электронной оболочке атома, K-оболочке, соответствующей первому энергетическому уровню.
Энергетические подуровни
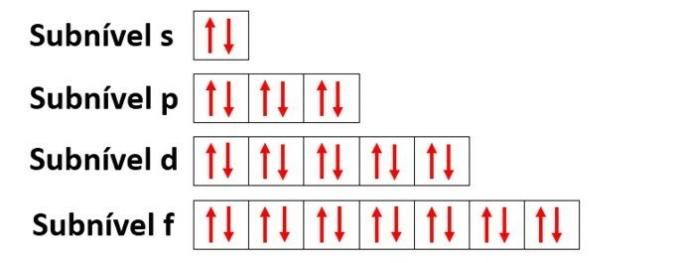
Уровни энергии содержат подуровни, которые представлены s, p, d, f. Каждый подуровень вмещает максимальное количество электронов, равное 2, 6, 10 и 14 соответственно.

С этой информацией можно электронное распределение атома и знать местонахождение самого удаленного и наиболее энергичного электрона.
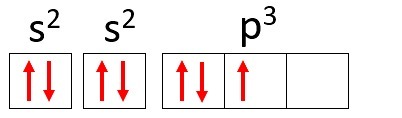
Пример: Азот (N)
Атомный номер: 7
Электронное распространение: 1 с2 2 с2 2p3
Атом азота имеет два энергетических уровня, K и L, а его 7 электронов занимают подуровни s и p.
К: с2 = 2 электрона
L: s2 + p3 = 5 электронов
Обратите внимание, что L-оболочка может содержать до 8 электронов, но в атоме азота в этой оболочке всего 5 электронов.
атомные орбитали
Орбитали характеризуют область, в которой с наибольшей вероятностью можно найти электрон на энергетическом подуровне (s, p, d, f) в электронной оболочке (K, L, M, N, O, P, Q).
- s подуровень: имеет 1 орбиталь, вмещающую до 2 электронов
- p подуровень: имеет 3 орбитали, в которых находится до 6 электронов
- Подуровень d: имеет 5 орбиталей, на которых размещается до 10 электронов.
- Подуровень f: имеет 7 орбиталей, на которых размещается до 14 электронов.
Если снова взять азот в качестве примера и распределить его 7 электронов по атомным орбиталям, мы получим:
Типы атомов
Наблюдая за количеством протонов, нейтронов и электронов, мы можем сравнивать атомы и классифицировать их на изотопы, изобары а также изотоны.
Химический элемент можно определить как группу атомов с одинаковым числом протонов. Эти атомы называются изотопами, потому что они имеют одинаковый атомный номер и разные массы.
Например, в природе существует 3 изотопа элемента водорода (H): протий , дейтерий
и тритий
.
Атомы различных химических элементов можно классифицировать как изотоны, если они имеют разные атомные номера и массы, но одинаковое количество нейтронов.
Изобары - это атомы разных элементов, то есть они имеют разный атомный номер, но одинаковое массовое число.
Узнать больше о изотопы, изобары и изотоны.
Атомные модели (атомные модели)
Греческий философ Аристотель (384 г. Ç. - 322 а. В) пытался объяснить строение всех веществ из элементов земли, воздуха, огня и воды.
Демокрит (546 г. С - 460 а. С), греческий ученый и математик, сформулировал идею о том, что существует предел малости частиц. Он сказал, что они станут настолько маленькими, что их больше нельзя будет разделить. Он назвал эту частицу «атомом».
Большую часть XIX века это был Атомная модель Дальтона, Английский ученый, предложивший атомную теорию, которая вышла далеко за пределы мысли древних.
Согласно этой теории, все вещества состоят из небольших неделимых частиц, называемых атомами, которые похожи на бильярдные шары. По мере продвижения исследований структуры материи было обнаружено, что атом образован другими небольшими частицами, называемыми субатомными частицами.
С открытием электрона, Томсон он сформулировал модель, известную как массовый пудинг, которая описывает атом как положительную сферу с отрицательно заряженными электронами, встроенными в ее поверхность.
Через эксперименты физик Резерфорд обнаружил, что у атома есть пустоты и электроны вокруг очень маленького положительного ядра. Таким образом, Резерфорд предложил ядерную модель для представления атома.
Бор улучшил модель, предложенную Резерфордом, обнаружив, что электроны вращаются вокруг ядра не случайным образом, а по определенным орбитам. Эта модель получила название планетарий.
Также читайте о:
- Атомные модели
- Модель атома Томсона
- Атомная модель Бора
- Атомная модель Резерфорда
- Эволюция атомных моделей


