Может случиться так, что есть кислоты одного и того же элемента, и этот элемент имеет одинаковую степень окисления (NOX), но разница заключается в степени гидратации.
Например, ниже у нас есть три кислоты, образованные элементом фосфор (P):
ЧАС3ПЫЛЬ4 ЧАС4п2О7 HPO3
Обратите внимание, что во всех трех кислотах степень окисления фосфора +5; разница в степени гидратации.
Исходя из этого, эти кислоты дифференцируются в номенклатуре через приставки орто, пиро и мета.
Наиболее гидратированная кислота называется орто.. В приведенном примере первая (H3ПЫЛЬ4) называется кислота ортофосфорный, потому что он самый гидратированный из трех. Префикс орто - одноразовый, поэтому большую часть времени эта кислота будет просто называться фосфорная кислота.
Приставки пиро и мета используются с орто-кислотой в качестве ориентира:
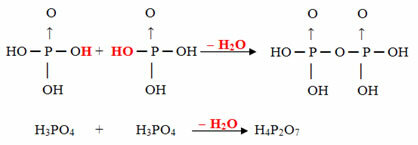
- Pyrus: 2 молекулы орто минус 1 молекула H2О
Пример: буква H4п2О7 называется кислота пирофосфорный потому что он равен двум молекулам ортофосфорной кислоты (H3ПЫЛЬ4) минус одна молекула воды.
2. ЧАС3ПЫЛЬ4 = H6п2О8
ЧАС6п2О8 - H2O = H4п2О7
Этот процесс межмолекулярная дегидратация:
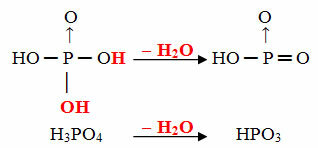
- Цель: 1 молекула орто минус 1 молекула H2О
Пример: HPO3 называется кислота Цельфосфорный потому что он равен молекуле ортофосфорной кислоты (H3ПЫЛЬ4) минус одна молекула воды.
ЧАС3ПЫЛЬ4 - H2O = HPO3
Этот процесс внутримолекулярная дегидратация:
Дженнифер Фогача
Окончила химический факультет
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
