Окислительно-восстановительные реакции включают перенос электронов между атомами, ионами или молекулами.
В реакции окисления-восстановления происходят изменения степени окисления (NOx). Окси-восстановление состоит из процессов окисления и восстановления:
- Окисление: приводит к потеря электронов и повышенный NOx.
- Снижение: приводит к электронное усиление и уменьшил NOx.
Когда один элемент отдает электроны, другой их получит. Таким образом, общее количество полученных электронов равно общему количеству потерянных электронов.
Примеры окислительно-восстановительных реакций на горение, коррозию и фотосинтез.
Примеры
В зависимости от элемента, который получает или отдает электроны, у нас есть следующие названия:
- Восстановитель: Тот, который подвергается окислению, вызывает восстановление и увеличивает количество NOx. Это то, что теряет электроны.
- Окислитель: Тот, который подвергается восстановлению, вызывает окисление и снижает его количество NOx. Это то, что получает электроны.
O степень окисления представляет собой электрический заряд элемента в то время, когда он участвует в химическая связь.
Это состояние связано с электроотрицательность, что является тенденцией некоторых элементов получать электроны.
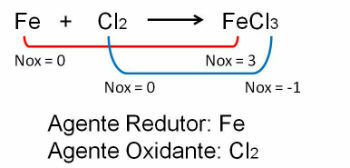
1. Обратите внимание на первый пример, обратите внимание, что в реакции между железом и хлором происходит изменение степени окисления. O хлор поскольку он более электроотрицателен, он получает электроны:
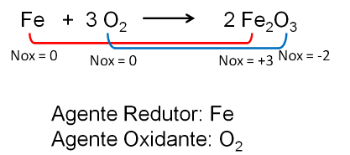
2. Взаимодействие железа и кислорода. Кислород более электроотрицателен и в конечном итоге получает электроны и снижает их степень окисления.
Узнать больше, читайте также:
- Окисление
- Горение
- Химические реакции
- электроны
Упражнение решено
1. (PUC-RS) По отношению к уравнению окисления - несбалансированное восстановление Fe0 + CuSO4 → Fe2(ТОЛЬКО4)3 + Cu0, можно сказать, что:
а) степень окисления меди в сульфате меди +1.
б) атом железа теряет 2 электрона.
в) медь подвергается окислению.
г) железо - окислитель.
д) железо подвергается окислению.
Разрешение:
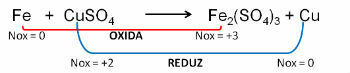
Отвечать:
д) железо подвергается окислению.
Упражнения
1. (UFAC-AC) В следующем химическом уравнении: Zn + 2 HCℓ → ZnCℓ2 + H2
а) элемент Zn окисляется и реагирует как окислитель.
б) элемент Zn окисляется и реагирует как восстановитель.
в) элемент Zn восстанавливается и реагирует как восстановитель.
г) HCℓ - восстановитель.
д) уравнение классифицируется как обратимое.
б) элемент Zn окисляется и реагирует как восстановитель.
2. (ITA-SP) В ионной реакции Ni (s) + Cu2+(водн.) → Ni2+(водн.) + Cu (s)
а) никель является окислителем, потому что он окисляется.
б) никель является восстановителем, потому что он окисляется.
в) ион меди является окислителем, потому что он окисляется.
г) ион меди является восстановителем, потому что он восстанавливается.
д) это не окислительно-восстановительная реакция, поэтому нет окислителя или восстановителя.
б) никель является восстановителем, потому что он окисляется.
3. (UFRGS) Активным агентом бытового отбеливателя является ион гипохлорита ClO-. В процессах отбеливания этот ион снижается; Это значит, что:
а) вещество, подвергающееся действию гипохлорита, получает электроны.
б) происходит уменьшение количества электронов в его структуре.
в) ClO- - восстановитель.
г) ClO- превращается в элементарный хлор или хлорид-ион.
д) не происходит переноса электронов.
г) ClO- превращается в элементарный хлор или хлорид-ион.