Периодические свойства химических элементов - это характеристики, которыми они обладают.
Обратите внимание, что химические элементы в периодической таблице имеют определенное местоположение, которое варьируется в зависимости от периодических свойств, которые они проявляют. Они отсортированы в порядке возрастания атомного номера.
Согласно закону Мозли:
“Многие физические и химические свойства элементов периодически изменяются в последовательности атомных номеров элементов..”
Основные периодические свойства
радиус атома
Связанное с размером атомов, это свойство определяется расстоянием между центрами ядер двух атомов одного и того же элемента.
Следовательно атомный луч соответствует половине расстояния между ядрами двух соседних атомов, которое выражается следующим образом:
г = d / 2
Где:
р: молния
d: межъядерное расстояние
Он измеряется в пикометры (вечера). Это измерение является долей метра:
13:00 = 10-12 м
В периодической таблице атомный радиус увеличивается сверху вниз в вертикальном положении. По горизонтали они увеличиваются справа налево.
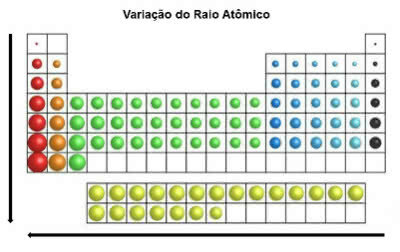
Изменение атомного радиуса
Химический элемент с наибольшим атомным радиусом - цезий (Cs).
Атомный объем
Это периодическое свойство указывает объем, занимаемый 1 моль элемента в твердом состоянии.
Стоит отметить, что атомный объем - это не объем 1 атома, а набор 6,02. 1023 атомы (значение 1 моль)
Атомный объем атома определяется не только объемом каждого атома, но и расстоянием между этими атомами.
В периодической таблице значения атомного объема увеличиваются сверху вниз (по вертикали) и от центра к краю (по горизонтали).

Изменение атомного объема
Для расчета атомного объема используется следующая формула:
V = м / д
Где:
V: атомный объем
м: масса 6,02. 1023 атомы элементов
d: плотность твердотельного элемента
Абсолютная плотность
THE плотность Абсолютная, также называемая «удельной массой», является периодическим свойством, которое определяет соотношение между массой (m) вещества и объемом (v), занимаемым этой массой.
Он рассчитывается по следующей формуле:
d = m / v
Где:
d: плотность
м: макароны
v: объем
В периодической таблице значения плотности увеличиваются сверху вниз (по вертикали) и от краев к центру (по горизонтали).
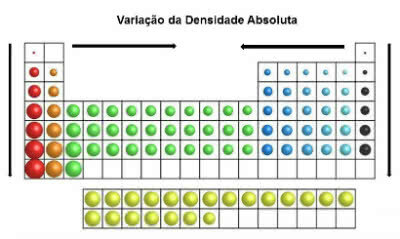
Изменение абсолютной плотности
Таким образом, наиболее плотные элементы находятся в центре и внизу таблицы:
Осмий (Os): d = 22,5 г / см3
Иридий (Ir): d = 22,4 г / см3
Точка плавления и точка кипения
Еще одно важное периодическое свойство связано с температурами, при которых элементы входят в плавление и кипение.
Точка плавления (ТП) - это температура, при которой вещество переходит из твердой фазы в жидкую. Точка кипения (PE) - это температура, при которой вещество переходит из жидкой фазы в газообразную.
В периодической таблице значения PF и PE варьируются в зависимости от сторон, расположенных в таблице.
По вертикали и в левой части стола они увеличиваются снизу вверх. С правой стороны они увеличиваются сверху вниз. В горизонтальном направлении они простираются от концов к центру.

Изменение температуры плавления и кипения
Электронное сродство
Также называется «электроаффинность», это минимальная энергия, необходимая химическому элементу для удаления электрона из аниона.
Это электронное сродство указывает количество энергии, высвобождаемой, когда электрон принимает атом.
Обратите внимание, что этот нестабильный атом находится в одиночестве и находится в газообразном состоянии. Благодаря этому свойству он приобретает устойчивость при приеме электрона.
В отличие от атомного радиуса, электроаффинность элементов в периодической таблице увеличивается слева направо по горизонтали. В вертикальном направлении он увеличивается снизу вверх.
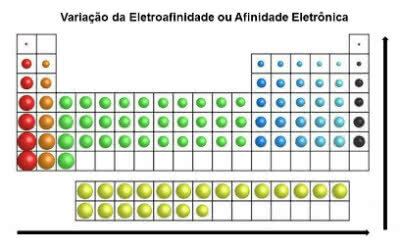
Электронная вариация сродства
Химический элемент, который имеет наибольшее сродство к электрону, - это хлор (Cl) со значением 349 кДж / моль.
Энергия ионизации
Также называемый "потенциал ионизации”, Это свойство противоречит электронному сродству.
Это минимальная энергия, необходимая химическому элементу для удаления электрона из нейтрального атома.
Таким образом, это периодическое свойство указывает, сколько энергии необходимо для передачи электрона от атома в основное состояние.
Так называемое «основное состояние атома» означает, что количество протонов в нем равно количеству электронов (p+ = и-).
Таким образом, после удаления электрона из атома он ионизируется. То есть он получает больше протонов, чем электронов, и поэтому становится катионом.
В периодической таблице энергия ионизации противоположна энергии атомного радиуса. Таким образом, он увеличивается слева направо и снизу вверх.
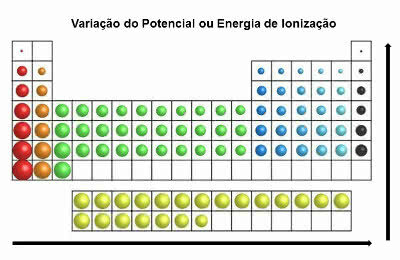
Изменение энергии ионизации
Элементами с наибольшим потенциалом ионизации являются фтор (F) и хлор (Cl).
электроотрицательность
Свойство атомов элементов, которые имеют тенденцию получать электроны в химической связи.
Это происходит в ковалентных связях во время обмена электронными парами. Получая электроны, атомы остаются с отрицательным зарядом (анион).
Помните, что это считается самым важным свойством таблицы Менделеева. Это связано с тем, что электроотрицательность вызывает поведение атомов, из которых образуются молекулы.
В периодической таблице электроотрицательность увеличивается слева направо (по горизонтали) и снизу вверх (по вертикали)
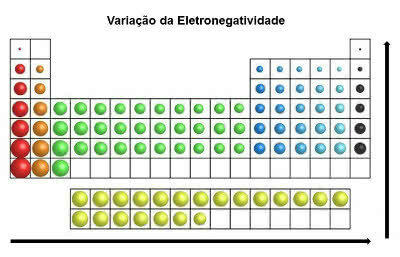
Вариация электроотрицательности
Таким образом, наиболее электроотрицательным элементом в таблице Менделеева является фтор (F). С другой стороны, цезий (Cs) и франций (Fr) являются наименее электроотрицательными элементами.
электроположительность
В отличие от электроотрицательности, это свойство элементарных атомов указывает на склонность терять (или отдавать) электроны в химической связи.
Теряя электроны, атомы элементов приобретают положительный заряд, образуя катион.
В том же направлении, что и атомный радиус, и вопреки электроотрицательности в периодической таблице a электроположительность увеличивается справа налево (по горизонтали) и сверху вниз (по вертикали).
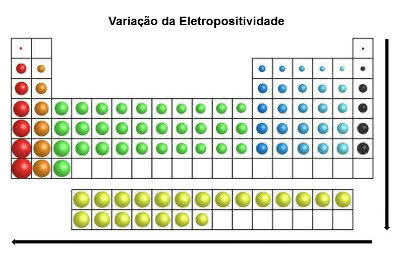
Вариация электроположительности
Химические элементы с наивысшей электроположительностью - это металлы, и по этой причине это свойство также называют «металлическим характером». Наиболее электроположительным элементом является франций (Fr) с максимальной склонностью к окислению.
Внимание!
Ты "благородные газы»Являются инертными элементами, поскольку они не проводят химических связей и почти не отдают или не принимают электроны. Кроме того, им сложно реагировать с другими элементами.
Поэтому электроотрицательность и электроположительность этих элементов не учитываются.
Читайте тоже:
- Химические связи
- История Периодической таблицы
- Семейства периодической таблицы
Апериодические свойства
Помимо периодических свойств, у нас есть апериодические свойства. В этом случае значения увеличиваются или уменьшаются в зависимости от атомного номера элементов.
Они получили это название, так как не подчиняются своему положению в таблице Менделеева, как периодическая. То есть они не повторяются регулярно.
Основные апериодические свойства:
- Атомная масса: Это свойство увеличивается с увеличением атомного номера.
- Удельная теплоемкость: это свойство уменьшается с увеличением атомного номера. Помните, что удельная теплоемкость - это количество тепла, необходимое для повышения температуры на 1 ° C 1 г элемента.
Упражнения для вступительных экзаменов с обратной связью
1. (PUC-RJ) Рассмотрим утверждения об элементах группы IA Периодической таблицы.
Я. Их называют щелочными металлами.
II. Его атомные лучи растут вместе с атомным номером.
III. Его потенциал ионизации увеличивается с атомным номером.
IV: Его металлический характер увеличивается с атомным номером.
Среди утверждений верны:
а) I и II
б) III и IV
в) I, II и IV
г) II, III и IV
д) I, II, III и IV
Альтернатива c
2. (UFMG) Сравнивая хлор и натрий, два химических элемента, которые образуют поваренную соль, можно сказать, что хлор:
а) более плотный.
б) менее летучий.
в) имеет более металлический характер.
г) имеет меньшую энергию ионизации.
д) имеет меньший атомный радиус.
Альтернатива и
3. (UFC-CE) Фотоэлектрический эффект состоит из испускания электронов с металлических поверхностей при падении света соответствующей частоты. На это явление напрямую влияет потенциал ионизации металлов, который в значительной степени подвергся воздействию используется в производстве фотоэлектронных устройств, таких как: фотоэлементы уличного освещения, фотоаппараты. фотографические и т. д. Основываясь на изменении потенциала ионизации элементов Периодической таблицы, отметьте альтернативу, которая содержит металл, наиболее вероятно проявляющий фотоэлектрический эффект.
а) Fe
б) Hg
в) Cs
г) Mg
д) Ca
Альтернатива c
Проверьте вопросы вступительного экзамена с комментариями к разрешению Упражнения с периодической таблицей и неопубликованные вопросы по теме в Упражнения по организации периодической таблицы.
Читайте тоже:
- Периодическая таблица
- Электронная раздача
- Химические элементы
- Межмолекулярные силы