определяет себя как гибридизация объединение неполных атомных орбиталей. Орбиталь классифицируется как неполная, если на ней имеется только один электрон внутри него вместо двух. См. Представление неполной орбитали и полной орбитали:

На изображении A у нас есть полная орбиталь; на изображении B - неполная орбиталь.
Гибридизация - это естественное явление, которое происходит с некоторыми химическими элементами, такими как фосфор, сера, углерод и т. Д. Гибридизация углерода позволяет атомам этого элемента быть способными образовывать четыре химические связи, то есть углерод образует только четыре связи после того, как подвергся явлению гибридизации.
Но почему углерод гибридизуется и образует четыре связи? Чтобы понять это явление, мы должны знать электронное распределение этого элемента:
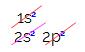
В электронном распределении углерода мы видим, что подуровень 1s завершен (с двумя электронами), подуровень 2s равен полный (с двумя электронами), а подуровень 2p неполный (подуровень p поддерживает шесть электронов, но есть только два). Распределяя 2p-электроны репрезентативным образом, мы должны:
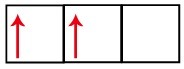
Подуровень p имеет три орбитали - в случае углерода две из них неполные, а одна пуста. По этой причине этот элемент должен выполнять только две ссылки, так как количество неполных орбиталей всегда определяет количество ссылок.
Однако при получении энергии от внешней среды электроны, присутствующие в углероде, возбуждаются. Таким образом, один из электронов, находящихся на подуровне 2s, перемещается на орбиталь пустого подуровня p:
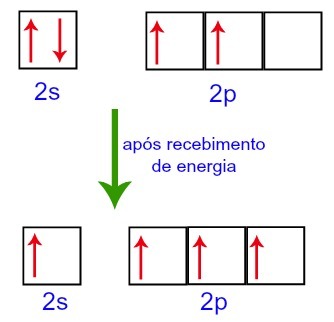
Углеродные орбитали до и после получения энергии из внешней среды
Таким образом, на втором уровне углерода остается четыре неполных орбитали. Затем орбиталь подуровня 2s соединяется с тремя p-орбиталями, что конфигурирует явление гибридизация.
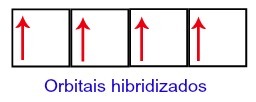
Углеродные орбитали после гибридизации
Автор: Диого Лопес Диас
Источник: Бразильская школа - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm


