Как объясняется в тексте «Типы межмолекулярных сил», молекулы веществ в трех физических состояниях (твердое, жидкое и газообразное) притягиваются одной из межмолекулярных сил.
Три известных межмолекулярных силы: индуцированный диполь - индуцированный диполь, постоянный диполь - постоянный диполь и водородная связь. Среди них водородная связь самая прочная. Некоторые авторы называли эту межмолекулярную силу водородными связями; однако правильным термином, принятым IUPAC, является «водородная связь».
Этот тип взаимодействия происходит, когда молекула имеет водородную связь с фтором, азотом или кислородом, которые являются сильно электроотрицательными атомами.

Водородная связь является крайним примером постоянной дипольной-постоянной дипольной связи. Поскольку водород молекулы составляет положительный полюс, который связывается с одним из тех атомов фтора, кислорода или азота другой молекулы, которые составляют их отрицательный полюс.
Обычно межмолекулярные связи возникают с веществами в жидком и твердом состояниях. Кроме того, поскольку это очень сильная сила притяжения, для ее разрушения требуется очень большая энергия.
Вещество, обладающее этой межмолекулярной силой, - это сама вода. Обратите внимание, как это происходит на иллюстрации ниже:
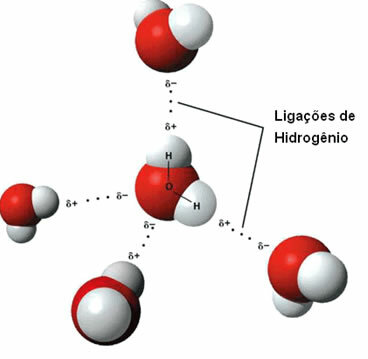
Обратите внимание, что каждая молекула воды пространственно окружена четырьмя другими молекулами воды со связями водорода возникают за счет связи между водородом одной молекулы (положительный полюс) с кислородом другой (полюс отрицательный).
Водородные связи объясняют различные явления в природе, см. Следующие примеры:
- То, что лед плавает по воде: Лед менее плотен, чем вода, и поэтому плавает по нему. Это связано с тем, что в то время как в жидком состоянии водородные связи, которые возникают между молекулами воды, расположены в неорганизованной форме, водородные связи в Молекулы льда более разнесены и организованы, образуя жесткую гексагональную структуру, из-за которой молекулы занимают гораздо большее пространство, чем если бы они находились в этом состоянии. жидкость.

Не останавливайся сейчас... После рекламы есть еще кое-что;)
Именно поэтому, если мы нальем воду во весь объем бутылки и поместим ее позже в холодильник, ее объем увеличится, и бутылка треснет.
Таким образом, будет такое же количество молекул в единице объема, что уменьшает плотность согласно формуле плотности: d = m / v. Между образовавшимися шестиугольниками будут пустые пространства, уменьшающие плотность этого вещества.
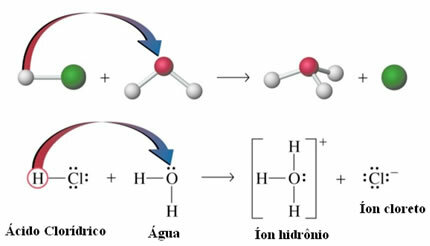
- Кислотная ионизация: Хотя водородные связи примерно в десять раз слабее ковалентных; при определенных обстоятельствах им удается разорвать ковалентные связи. Например, в случае, показанном ниже, соляная кислота растворяется в воде. Кислород в воде притягивает водород, связанный с хлором кислоты, больше, чем сам хлор, вызывая образование ионов гидроксония (H3О+) и хлорид (Cl-). Это явление называется ионизацией:
- Поверхностное натяжение воды: молекулы на поверхности жидкости притягиваются водородными связями только с молекулами рядом с ними и ниже, поскольку наверху нет молекул. С другой стороны, молекулы, которые находятся под поверхностью, осуществляют этот тип связывания с молекулами во всех направлениях, в результате на поверхности воды образуется своего рода пленка или тонкий слой, который вовлекает.
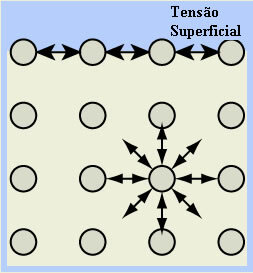
Этим объясняется то, что на нем могут оставаться насекомые, а также феномен сферической формы водяных капель.

Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. "Водородные связи"; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/ligacoes-hidrogenio.htm. Доступ 27 июня 2021 г.
Химия

Загрязнение воды, физические аспекты воды, химические аспекты воды, биологические аспекты воды, промышленные отходы, тяжелые металлы, питьевая вода, органические вещества, мутность воды, сточные воды.


