О нитрат аммония твердое вещество с молекулярной формулой NH4НА3 и белый внешний вид (в чистом виде). составлен посредством ионы NH4+ (аммоний) и NO3- (нитрат), не горюч, но обладает высокой окислительной способностью и реакционной способностью. В результате реакции его разложения в качестве продукта образуется большой объем газов, что делает неправильное хранение этого продукта серьезной проблемой, так как могут произойти взрывы. А также широко используется в сельском хозяйстве как удобрение.
Читайте тоже: Природные вещества - молекулы, произошедшие от природы
Что такое нитрат аммония?

Нитрат аммония это соль состоит из ионов NH4+ (аммоний) и NO3- (нитрат). Это твердое соединение, которое, когда чистый, это белый цвет. Он широко используется в качестве сельскохозяйственных удобрений, но его также можно использовать при производстве взрывчатых веществ, например это очень окисляющее вещество, затем окислительный. Неуправляемая реакция нитрата аммония приводит к высокому выбросу газы, вызывая взрывной удар.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Характеристики нитрата аммония
Молярная масса: 80,04336 г / моль.
Соль, состоящая из ионов: аммония (NH4+) и нитратов (NO3-).
Внешний вид: белое твердое вещество.
Сильно окисляет.
Легко вступает в реакцию с другими веществами.
Не горюч.
Для нормальных условий температуры и давления:
- плотность: 1,73 г / см³;
- температура кипения: 210 ° С;
- температура плавления: 169,6 ° С;
- степень растворимости в воде: 216 г / 100 мл;
- pH: 5,5 (0,2 М).
Формула нитрата аммония
Молекулярная формула этого соединения - NH4НА3.

Разложение нитрата аммония
за то, чтобы быть вещество с высокой реакционной способностью и высоким окислительным потенциалом, нитрат аммония при воздействии высокой температуры вызывает реакция разложения, а основными продуктами являются газы, азот, кислород и водяной пар. Разложение проводится в два этапа:
→ 1 шаг:
2NH4НА3 (с) → 2N2О (г) + 4Н2O (г)
→ 2 этап:
2N2O → 2N2(г) + O2(грамм)
→ Глобальное уравнение:
2NH4НА3 (с) → 2N2(г) + O2(г) + 4Н2O (г)
Обратите внимание, что в первом уравненииодин из продуктов в разложении получается закись азота (N2O), также известен как веселящий газ. Он используется для увеличения мощности автомобильных двигателей для сжигания топлива и в качестве обезболивающего, в основном стоматологами. Это также один из основных газов, ответственных за парниковый эффект.
Смотрите также: Какие бывают типы химических реакций?
Производство аммиачной селитры
Аммиачную селитру можно получить реакция между сульфатом аммония (NH4)2ТОЛЬКО4 и нитрат кальция Ca (NO3)2. См. ниже:
(NH4)2ТОЛЬКО4 + Ca (НЕТ3)2 → 2 NH4НА3+ Чехол4
Его также можно производить из газообразного аммиака., который барботируют в растворе азотной кислоты, имеющем в качестве продукта реакции водный нитрат аммония. Посмотрите:
NH3 (г) + HNO3 (водн.) → NH4НА3(здесь)
Использование нитрата аммония

- Производство удобрений
- Взрывчатые вещества в шахтах, карьерах и строительстве
- Гербициды и инсектициды
- Получение закиси азота для промышленного применения
- Абсорбенты для оксидов
- Окислитель для ракетного топлива
- Производство изотермических мешков
- Производство анестезирующего дыма для содержания ульев в пчеловодстве
Также доступ: Как бороться с огнем?
Опасности, связанные с нитратом аммония
Один из основных рисков, связанных с нитратом аммония, заключается в ненадлежащее хранение. Поскольку это очень окисляющее вещество и оно реагирует с несколькими другими соединениями, оно вызывает реакция с выделением большого объема газа. Неправильное хранение может привести к загрязнению легковоспламеняющимися продуктами, воздействию тепла или задержке газов, что может вызвать взрывы.
Это уже произошло в Техасе, например в США, с грузовым судном, прибывшим из Франции, на борту которого находилось 2086 тонн нитрата аммония. авария произошла в 1947 г. и стала известна как катастрофа в Техас-Сити. В результате трагедии погиб 581 человек. и это произошло из-за пожара, не содержащегося в судне, который достиг груза аммония, вызвав взрыв.
Другим примером был последовательность взрыва что произошло 4 августа 2020 года в порту г. город Бейрут, Ливан, в результате чего более 100 человек погибли и 5000 получили ранения. Масштабы взрыва были вызваны возгоранием в результате цепной реакции груза, содержащего 2750 тонн нитрата аммония, хранящегося там.
Также стоит отметить, что нитрат аммония может вызывать раздражение кожи и глаз и при вдыхании проблемы с дыханием. В кровотоке это вещество обладает токсической силой, поскольку оно вступает в реакцию с биологическими жидкостями, и продукты этой реакции, такие как нитрат, могут причинить вред здоровью, например: болезнь голубого ребенка, также известна как детская метгемоглобинемия (низкий гемоглобин в крови). Это заболевание рецидивирует в семьях в сельской местности из-за загрязнения водоемов в сельскохозяйственных районах нитратом аммония, содержащимся в удобрениях.
Лайса Бернардес
Учитель химии
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
ARAúJO, Лайса Бернардес Маркес де. "Нитрат аммония"; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Доступ 27 июня 2021 г.
Биология
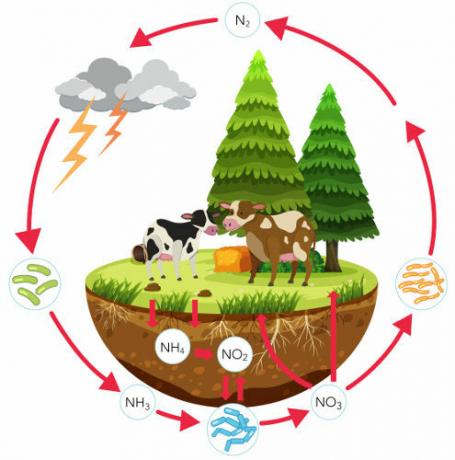
Узнайте больше об азотном цикле, важном биогеохимическом цикле, который обеспечивает циркуляцию этого элемента. В этом тексте мы рассмотрим каждый этап азотного цикла, обсудим его важность и сосредоточимся на роли бактерий в этом процессе. Мы также представим упражнения по этой теме.