THE Химическая кинетика это область, изучающая факторы, влияющие на скорость развития химических реакций, то есть скорость, с которой они происходят. В этой области проводится все больше и больше исследований, поскольку мы часто хотим ускорить одни реакции или замедлить другие. Это особенно важно для промышленности, и это исследование имеет важные технологические последствия.
Но поскольку скорость реакции может меняться в каждый временной интервал и от одного вещества к другому, принято рассчитывать средняя скорость реакции.
Рассмотрим следующую общую реакцию, в которой коэффициенты представлены строчными буквами, а реагенты и продукты представлены прописными буквами:
а А + б В → в С + г Д
Будет дана средняя скорость этой реакции. деление средней скорости реакции любого из реагирующих веществ или средней скорости образования любого из продуктов на соответствующий коэффициент в химическом уравнении. Это дает:
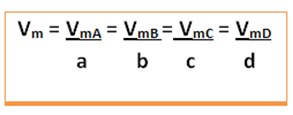
Например, рассмотрим реакцию разложения перекиси водорода:
2 часа2О2 (водн.) → 2 H2О(1) + 1 O2 (г)
Допустим, за 1 минуту образовалось 0,3 моль / л H.2O и 0,15 моль / л O2, а 0,3 моль / л H разлагается2О2, то есть средние скорости разложения и образования этих веществ в реакции составляют:
VмH2O2 = 0,3 моль / л. мин
VmH2O = 0,3 моль / л. мин
VmO2 = 0,15 моль / л. мин
Средняя скорость глобальной реакции будет найдена, если взять одно из этих значений и разделить его на соответствующий коэффициент в уравнении:
Vм = VмH2O2 = 0,3 моль / л. мин = 0,15 моль / л. мин
2 2
Vм = VmH2O = 0,3 моль / л. мин = 0,15 моль / л. мин
2 2
Vм = VmO2 = 0,15 моль / л. мин = 0,15 моль / л. мин
1 1
Обратите внимание, что три значения равны, следовательно, скорость реакции такая же, как функция любого реагента или продукта в одном и том же интервале времени.
Однако как были найдены значения средних скоростей каждого из веществ, участвующих в этих реакциях?
Его можно рассчитать деление изменения концентрации вещества (реагента или продукта) на временной интервал. Если мы собираемся определить среднюю скорость одного из реагенты реакции, мы должны будем поставить отрицательный знак раньше, или еще рассмотрите значение концентрации в модуле ||, поскольку, поскольку концентрация реагента со временем уменьшается, значение скорости будет отрицательным, но отрицательной скорости нет.
Не останавливайся сейчас... После рекламы есть еще кое-что;)

Например, рассмотрим следующую реакцию разложения газообразного озона (O3 (г)) в газообразном кислороде (O2 (г)):
2 O3 (г) → 3 O2 (г)
Допустим, в воздушном шаре было 10 молей озона, но через 1 минуту осталось только 4 моля; это означает, что 6 молей озона превратились в газообразный кислород. Итак, у нас есть:
2 O3 (г) → 3 O2 (г)
t = 0 мин 2 моль / л 0 моль / л
расходы сформированы
6 моль / л 9 моль / л
t = 1 мин 4 моль / л 9 моль / л
Обратите внимание, что, поскольку соотношение в реакциях составляет 2: 3, то, если было использовано 6 моль O3, 9 моль O образовалось2. Итак, через 1 минуту мы имеем следующие средние скорости:
Vм = - ∆ [The3]
т
Vм = - ([O3финал - О3 начальный])
тФинал - тисходный
Vм = - ([4 - 10])
1– 0
Vм = 6 моль / л. мин→ За 1 минуту в каждом литре системы прореагировало 6 моль озона.
Vм = ∆ [The2]
т
Vм = ([O2финал - О2 начальный])
тФинал - тисходный
Vм = ([9 - 0])
1– 0
Vм = 9 моль / л. мин→ За 1 минуту в каждом литре системы образовалось 9 молей кислорода.
Это показывает нам, что мы можем рассчитать среднюю скорость как функцию реагентов или как функцию продуктов.
Теперь, если мы хотим вычислить среднюю скорость этой глобальной реакции, просто сделайте так, как мы показали в начале: разделите каждую из этих скоростей на соответствующие коэффициенты в химическом уравнении:
Vм = VmO3 = 6 моль / л. мин = 3 моль / л. мин
2 21
Vм = VmO2 = 9 моль / л. мин = 3 моль / л. мин
3 3
Vм = VmO3 = VmO2
23
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Скорость химических реакций»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Доступ 27 июня 2021 г.

