В этом тексте мы увидим, как диаграмма изменение физического состояния любому чистое вещество, как интерпретировать этот тип диаграммы и как представлен график смесей.
Для этого рассмотрим на примере воды. Представьте, что мы берем стакан льда с температурой –10 ºC и запускаем процесс нагрева под давлением 1 атм. При повышении температуры от -10 ºC до -9 ºC, до -8 ºC и так далее, лед остается в твердом состоянии, пока не достигнет температуры 0 ºC.
В этот момент он начинает переходить в жидкое состояние, то есть начинается синтез. Температура не будет продолжать расти, как раньше, но будет оставаться постоянной на уровне 0 ° C до тех пор, пока весь лед не растает:

После плавления всего твердого вещества температура системы будет продолжать повышаться, пока не достигнет 100 ° C. При этой температуре вода, которая была в жидком состоянии, начнет переходить в парообразное состояние, то есть закипит.
Так же, как это случилось в точка слияния, при температуре кипения температура также будет оставаться постоянной, пока вся жидкость не превратится в пар. После этого, если мы продолжим нагревать систему, температура продолжит расти:
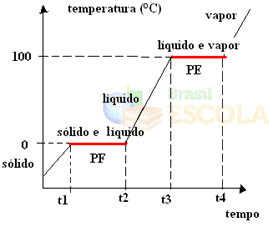
Готовый! Это график или диаграмма, которые представляют изменение физического состояния воды или ее кривой нагрева. Если бы это был обратный процесс, у нас была бы следующая кривая водяного охлаждения:
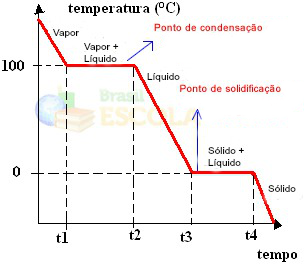
Очень важным аспектом этих графиков является то, что они образованы двумя уровнями, то есть есть две точки, в которых температура остается постоянной в течение некоторого времени. Это всегда происходит при изменении состояния чистого вещества. Единственная разница - это значения температуры плавления и кипения.
Не останавливайся сейчас... После рекламы есть еще кое-что;)
Кислород, например, в отличие от воды, не жидкость, а газ при комнатной температуре (около 20ºC). Это связано с тем, что его температура плавления на уровне моря составляет -223,0 ° C, а температура кипения -183,0 ° C. См. График изменения вашего физического состояния:

Общая графика микширования
Если мы нагреваем или охлаждаем смесь, точки плавления и кипения не будут иметь определенные и постоянные значения, то есть два уровня, наблюдаемые на графиках, не будут сформированы выше.
Изменения в физических состояниях будут происходить в диапазоне температур, а не в фиксированном количестве. Например, точка плавления будет начинаться при данной температуре и заканчиваться при другой, и то же самое произойдет с точкой кипения, как показано на следующем графике:
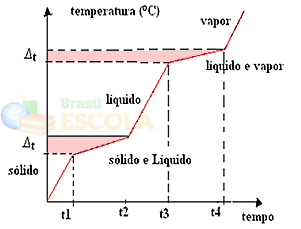
Двумя исключениями являются эвтектические и азеотропные смеси. Посмотрите, что с ними происходит:
а) Эвтектическая смесь
Эвтектическая смесь во время плавления ведет себя так, как если бы она была чистым веществом, то есть в этот момент температура остается постоянной от начала до конца изменения агрегатного состояния.

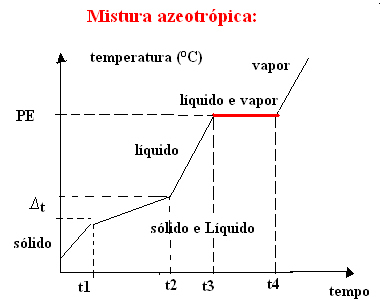
б) азеотропная смесь
Азеотропная смесь ведет себя как чистое вещество при кипении, то есть в этот момент температура остается постоянной от начала до конца изменения агрегатного состояния.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Графики изменения физического состояния»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm. Доступ 28 июня 2021 г.