Катализаторы - это вещества, способные без изменения ускорять реакцию, то есть они не расходуются во время реакции.
Чтобы понять, как работают катализаторы, нам нужно вспомнить, что было объяснено в тексте "Энергия активации”. Как показано там, для начала химической реакции необходимо, чтобы реагенты обладали или получали определенное количество минимальной энергии, которое называется энергия активации.
При этой минимальной энергии реагенты могут достигать комплекс активирован, которое является промежуточным состоянием (переходным состоянием), которое образуется между реагентами и продуктами, в котором структуры существуют ослабленные предыдущие ссылки и образование новых ссылок (присутствующих в продукты).
Например, рассмотрим общую реакцию ниже:
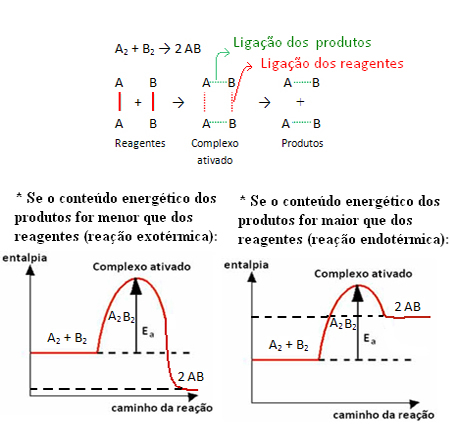
Обратите внимание, что энергия активации, необходимая для достижения активированного комплекса, становится своего рода препятствием, которое необходимо преодолеть, чтобы реакция произошла. Это означает, что чем больше энергия активации реакции, тем большее препятствие необходимо преодолеть и тем медленнее скорость реакции.
Верно и обратное: чем ниже энергия активации, тем быстрее будет реакция. Это именно то, что катализаторы они они создают альтернативный путь, который требует меньше энергии активации, заставляя реакцию протекать быстрее.
Не останавливайся сейчас... После рекламы есть еще кое-что;)

Чтобы снизить энергию активации, катализатор действует, изменяя механизм реакции, комбинируя с реагентами в системе, которая может быть однофазной (гомогенный катализ) или многофазной (гетерогенный катализ).
Более подробную информацию об этих типах катализа можно увидеть в текстах ниже:
- гомогенный катализ
- гетерогенный катализ
Но в целом можно сказать, что это Комбинация реагента и катализатора образует промежуточное соединение, которое затем превращается, давая продукт и катализатор. Обратите внимание, как это можно представить:
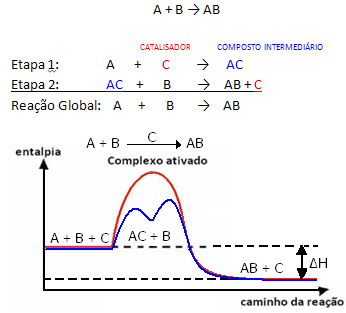
Следите за тем, чтобы катализатор регенерировался в конце реакции, а не потреблялся им.
Важным фактом является то, что катализатор ускоряет как прямую, так и обратную реакции, что означает уменьшение энергии активации обоих.
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы ссылаться на этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Как действуют каталитические вещества?»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Доступ 27 июня 2021 г.


