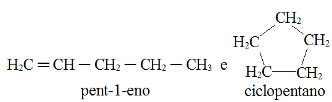Согласно модели орбиталей, созданной Линусом Полингом в 1960 году, ковалентная связь, образующая молекул происходит путем слияния или взаимопроникновения неполных орбиталей элементов, участвующих в Ссылка на сайт. Таким образом, делается вывод, что если элемент имеет неполную орбиталь (только с одним электроном), он может образовывать только ковалентную связь. Если у него две неполные орбитали, он может сделать максимум два соединения и так далее.
Однако посмотрите на атомные орбитали атома углерода элемента, атомный номер которого равен 6 (Z = 6):
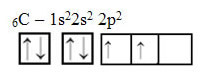
Обратите внимание, что он имеет две неполные орбитали, поэтому он должен выполнять не более двух привязок. Однако с ним происходит не это. Как многие знают, углерод образует четыре связи (он четырехвалентен), поэтому эта модель орбиталей не объясняет случай углерода.
Чтобы выйти из этого тупика, была создана новая теория, которая лучше объясняла эту проблему: Теория гибридизации.

Это означает, что гибридизация представляет собой «смесь» чистых орбиталей.
Для углерода существует три типа гибридизации, а именно: sp.3, sp2 и sp.
Чтобы понять, как происходит гибридизация, давайте рассмотрим первый тип углеродной гибридизации, sp-тип.3:
Этот тип гибридизации происходит в молекуле метана (CH4). Обратите внимание, что существует четыре идентичных ковалентных связи между углеродом, который является центральным элементом, и четырьмя атомами водорода. Итак, посмотрите, что такое неполная водородная орбиталь:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
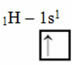
Поскольку каждый водород имеет неполную орбиталь s-типа, необходимо получить еще один электрон, то есть каждый из них образует только одну ковалентную связь с углеродом. Вот почему углерод должен иметь четыре неполные орбитали. Как это произошло? Через гибридизацию.
Когда электрон с 2s-орбитали поглощает энергию, он переходит на пустую 2p-орбиталь. Таким образом, мы говорим, что этот скачок электрона с подуровня 2s на подуровень 2p является «продвижением» электрона. Таким образом, углерод остается в возбужденном или активированном состоянии с четырьмя гибридизированными орбиталями, доступными для выполнения ковалентных связей:
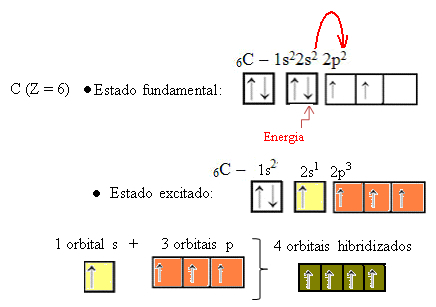
Обратите внимание, что сформированные гибридные орбитали эквивалентны друг другу, но отличаются от исходных чистых орбиталей.
Таким образом, связь между s-орбиталью каждого из четырех атомов водорода возникает с этими четырьмя гибридизированными углеродными орбиталями:
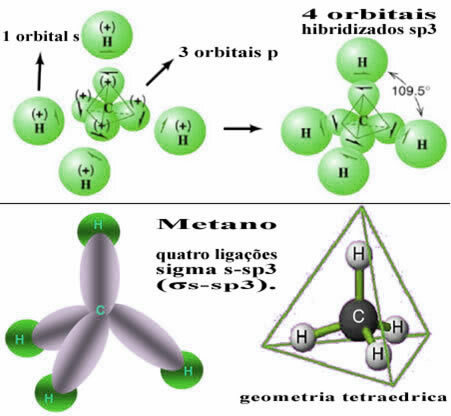
Как видно выше, молекула метана имеет правильную структуру тетраэдра с четырьмя электронными облаками в каждой вершине и примыкающими углами 109 ° 28 ’. Поскольку связь была сделана между s-орбиталью каждого водорода и гибридизированной sp-орбиталью3 для каждого соединения, то мы имеем, что они четыре сигма s-sp ссылки3 (σs-sp3).
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Гибридизация типа Sp3»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm. Доступ 28 июня 2021 г.