О принцип Ле Шателье говорит нам, что когда в системе, находящейся в состоянии равновесия, возникает нарушение, она смещается в направлении, которое сводит к минимуму силы, создаваемые этим нарушением, и восстанавливает новое химическое равновесие.
Одно из этих расстройств - изменение температуры. Это изменение важно, потому что, помимо смещения равновесия, оно также изменит значение константы равновесия Kç.
Чтобы вы лучше понимали, как это происходит, давайте рассмотрим пример:
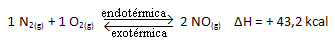
Kç = _ [НА]2___
[N2]. [O2]
Вышеуказанная реакция протекает в прямом направлении с поглощением энергии, она эндотермическая. С другой стороны, обратный процесс происходит с выделением энергии, являясь экзотермической реакцией.
Таким образом, если мы увеличим температуру системы, химическое равновесие сместится в сторону эндотермической реакции, которая в этой реакции протекает вправо. Это необходимо для поглощения тепла и восстановления равновесия.
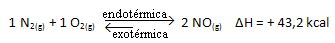
Обратное тоже верно; если мы понизим температуру этой системы, реакция сместится в сторону выделения тепла, потому что общая энергия реакции уменьшится. Это означает, что баланс сместится в сторону экзотермической реакции, которая в данном случае находится влево:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
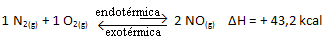
Коротко:

По отношению к константе равновесия (Kç), когда температура увеличивается, это способствует эндотермической реакции и большему количеству NO(грамм) образуется, увеличивая его концентрацию и уменьшая концентрацию реагентов. Обратите внимание на формулу ниже, что концентрация NO(грамм) прямо пропорциональна постоянной Kç, следовательно, и увеличивается:
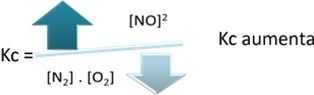
Но если мы уменьшим температуру, сдвинув реакцию в сторону экзотермической реакции, концентрация продукта NO будет уменьшаться, а концентрации реагентов увеличиваться. Поскольку концентрации реагентов обратно пропорциональны постоянной Kc, то она будет уменьшаться:
Дженнифер Фогача
Окончила химический факультет
Хотели бы вы использовать этот текст в учебе или учебе? Посмотрите:
FOGAÇA, Дженнифер Роча Варгас. «Изменение температуры и сдвиг химического равновесия»; Бразильская школа. Доступно в: https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm. Доступ 28 июня 2021 г.
Химия

Проверьте свои знания и узнайте больше с этим списком решенных упражнений на химические весы. Благодаря этому материалу вы сможете лучше понять, как работают константы равновесия (Kp, Kc и Ki), сдвиг равновесия, pH и pOH, а также равновесие в так называемых буферных растворах.