Электролиз это физико-химический процесс, в котором используется электрическая энергия из любого источника (например, аккумулятор или батарея), чтобы вызвать химическую реакцию с образованием простых или сложных веществ, которые нельзя найти в природе или которые не встречаются в больших количествах.
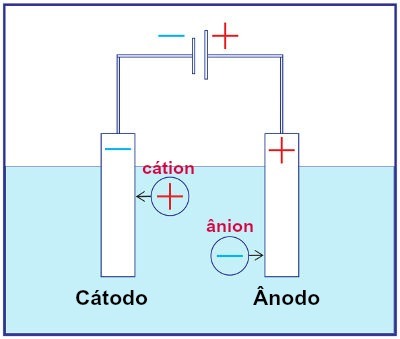
Представление сборки любой электролизной системы
Во время электролиза катион восстанавливается на катоде, а анион окисляется на аноде. Это происходит из-за электрического разряда от внешнего источника. Таким образом, при электролизе происходит неспонтанная реакция окисления и восстановления.
Теперь разберитесь в двух способах электролиза:
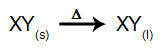
В этом типе электролиза мы используем ионное вещество в жидком состоянии в электролитической ванне. Когда ионное вещество (XY) подвергается плавлению, оно претерпевает процесс диссоциация, как показано ниже:

Затем при включении источника питания катион (X+) движется к катоду, а анионы (Y-) двигаться к аноду. Тем самым:
На катоде: катионы получают электроны (они восстанавливаются) и превращаются в стабильное вещество (X), процесс представлен следующим уравнением:
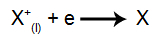
На аноде: анионы теряют электроны (они подвергаются окислению) и становятся стабильным веществом (X), процесс представлен следующим уравнением:

а) Пример магматического электролиза
В качестве примера рассмотрим теперь огненный электролиз хлорид натрия (NaCl). Когда хлорид натрия (NaCl) подвергается плавлению, он подвергается процессу диссоциации, как показано ниже:
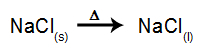
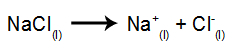
Затем при включении источника питания катион (Na+) движется к катоду, а анионы (Cl-) двигаться к аноду. Тем самым:
На катоде: катионы в+ они получают электроны (они восстанавливаются) и становятся стабильным веществом (Na, который представляет собой твердый металл), процесс, представленный уравнением ниже:

На аноде: анионы Cl- они теряют электроны (окисляются) и становятся стабильным веществом (Cl2, который является газообразным), процесс представлен уравнением ниже:

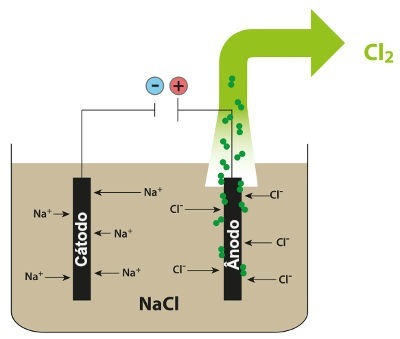
Схема, демонстрирующая магматический электролиз NaCl
Таким образом, при магматическом электролизе хлорида натрия мы имеем образование металлического натрия (Na) и газообразного хлора (Cl2).
В этом типе электролиза мы используем ионное вещество, растворенное в воде внутри электролитического резервуара. Итак, перед проведением электролиза сначала перемешиваем вещество (обычно соль неорганический) в воде, чтобы вызвать ее диссоциацию (высвобождение катиона и аниона), как показано ниже:
Не останавливайся сейчас... После рекламы есть еще кое-что;)
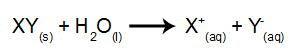
Отличие от магматического электролиза состоит в том, что, помимо ионов от диссоциации, мы также имеем ионы от самоионизации воды. В процессе самоионизации вода производит катион гидроксония (H+) и гидроксид-анион (OH-), как в уравнении ниже:

Таким образом, внутри электролитической ванны присутствуют два катиона (один из вещества ионный и один из воды) и два аниона (один из ионного вещества, а другой из Воды).
Чтобы знать, какой катион переместится к катоду, а какой анион переместится к аноду, необходимо знать порядок разряда катионов и анионов.
Для катионов:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> гидроксоний> семейство IIIA> семейство IIA> семейство IA
для анионов
Неокисленные анионы и HSO4 > гидроксид> кислородсодержащие анионы и F
Затем при включении источника питания катион (X+) движется к катоду, и один из анионов (Y-) движется к аноду.
На катоде: катионы получают электроны (они восстанавливаются) и превращаются в стабильное вещество (X), процесс представлен уравнением ниже:

На аноде: анионы теряют электроны (они подвергаются окислению) и превращаются в стабильное вещество (Y), процесс представлен уравнением ниже:
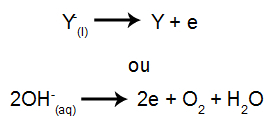
а) Пример водного электролиза
В качестве примера воспользуемся водным электролизом хлорида натрия (NaCl). Когда хлорид натрия (NaCl) растворяется в воде, он подвергается диссоциации, как показано ниже:
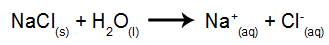
Помимо диссоциации NaCl, мы имеем дело с самоионизацией воды:

Итак, у нас есть катионы H+ и дальше+ и анионы ОН- и Cl-. Тогда при включении источника питания имеем следующее:
на катоде: катионы H+ получают электроны (восстанавливаются) и становятся стабильным веществом (H2, который является газом). Это связано с тем, что гидроксоний имеет приоритет по разряду перед элементами семейства IA (в данном случае Na). Процесс представлен приведенным ниже уравнением:
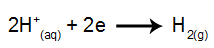
на аноде: анионы Cl- они теряют электроны (окисляются) и становятся стабильным веществом (Cl2, которая является газообразной). Это потому, что Cl- это не кислородсодержащий анион и имеет приоритет разряда над гидроксидом, процесс представлен уравнением ниже:


Схема, демонстрирующая водный электролиз NaCl
Таким образом, при водном электролизе хлорида натрия происходит образование газообразного водорода (H2) и газообразный хлор (Cl2).
Автор: Диого Лопес Диас
Химия

Применения электролиза, гальваники, никелирования, хромирования, никеля, хрома, катода, натрия, алюминия, хлора, каустическая сода, газообразный водород, магматический электролиз, водный электролиз, щелочные металлы, щелочноземельные металлы, газ хлор.